Amenorrea hipotalámica funcional: Guía de práctica clínica
Functional hypothalamic amenorrhea: an Endocrine Society Clinical Practice Guideline
Comentario Bibliográfico • (J Clin Endocrinol Metab 2017 May; 102(5):1413-1439)
Traducción: Dra. María Zabalza*
El subcomité de Guías Clínicas de la Sociedad de Endocrinología consideró necesaria la confección de una guía de práctica clínica para el manejo y comprensión de la amenorrea hipotalámica funcional (AHF), por lo que convocó a un grupo de trabajo para formular recomendaciones basadas en la evidencia. Dicho grupo de trabajo utilizó la mejor evidencia disponible hasta el momento para elaborar las recomendaciones.
En términos de fortaleza en la recomendación, para las fuertes se utiliza la frase “se recomienda” y para las débiles, “se sugiere”. La calidad de la evidencia se grafica con los siguientes indicadores: ⊕OOO para muy baja calidad de evidencia, ⊕⊕OO baja calidad, ⊕⊕⊕O moderada calidad y ⊕⊕⊕⊕ buena calidad.
En esta guía, el grupo de trabajo también enfatiza la importancia de la toma conjunta de decisiones, las medidas preventivas generales y los principios básicos del tratamiento de la AHF. Rotulan estas afirmaciones como de “buena práctica”. No existe evidencia directa o sistemáticamente evaluada. La intención de estas afirmaciones es recordar estos principios a los médicos tratantes y no deben ser considerados como recomendaciones válidas.
La AHF es una forma de anovulación crónica que no se debe a una causa orgánica identificable. El término “funcional” implica que la corrección de los factores conductuales causantes restablece la función ovulatoria. La causa de la anovulación es una reducción funcional de hormona liberadora de gonadotrofinas (GnRH), que se manifiesta con una disminución de la frecuencia de los pulsos de hormona luteinizante (LH). Los niveles resultantes de LH y de hormona foliculoestimulante (FSH) son insuficientes para mantener la foliculogénesis y la ovulación. La administración de GnRH o gonadotrofinas exógenas restablece la foliculogénesis. Klinefelter y cols. describieron originalmente esta condición con el término “hipoestrogenismo hipotalámico”. Además, podría existir una predisposición genética para el desarrollo de la AHF, tal como la heterocigosidad para hipogonadismo hipogonadotrófico congénito.
Son muchas las señales neuromoduladoras que regulan la secreción de GnRH. Algunas son estimulantes y otras inhiben la secreción de GnRH.
Existe un fuerte nexo entre la activación del eje hipotálamo-hipófiso-adrenal (HHA) y la reducción en la liberación de GnRH en las pacientes con AHF, evidenciándose hipercortisolemia tanto en atletas y no atletas en amenorrea. La deprivación nutricional aguda activa el eje HHA y reduce la pulsatilidad de la LH. Considerando el gasto energético que implica la reproducción, los factores metabólicos juegan un rol fundamental en el control de la función reproductiva. Es muy frecuente ver este fenómeno en mujeres atletas que consumen en el ejercicio más calorías de las que incorporan en la dieta. Las influencias psicosociales también activan el eje HHA y alteran la cascada neuromoduladora que regula al GnRH. Es más, los disruptores endocrinos exógenos como el bisfenol A pueden afectar la actividad de las neuronas secretoras de GnRH y el sistema de las kisspeptinas al modular la transcripción del gen de GnRH y/o por sus acciones agonista y antagonista de estrógenos. La reversión de la amenorrea al realizar modificaciones conductuales se asocia con una reducción de los niveles de cortisol y la restauración de la función ovárica en algunas mujeres con AHF. La kisspeptina juega un rol clave en el comienzo de la secreción de GnRH durante la pubertad. Las células kisspeptina/neuroquinina B/dinorfina que se encuentran en el núcleo arcuato secretan kisspeptina, que estimula las células productoras de GnRH. Estas neuronas secretoras de kisspeptina podrían ser el eslabón final común que integra otros sistemas de señalización y llevan a la disminución de la pulsatilidad de la GnRH.
Los estresores, independientemente del tipo, activan el eje HHA y el sistema nervioso autónomo, generando alteraciones neuroendocrinas, incluido el hipotiroidismo hipotalámico que conserva y desvía el gasto energético.
Muchas de las consecuencias que tiene la AHF sobre la salud se deben a una alteración combinada en el metabolismo, función neuroendocrina y la anovulación, que se asocian a dicha patología. La información disponible sugiere que las intervenciones apropiadas sobre el comportamiento tienen el potencial de corregir la función ovárica, metabólica y neuroendocrina. Los estudios han demostrado mayor prevalencia de trastornos de la conducta alimentaria (TCA) en mujeres con AHF que en los controles. Los estudios reportaron que las mujeres con AHF tenían mayores puntuaciones en escalas de comportamiento alimentario, lo que indica mayor prevalencia de dietas, bulimia, preocupación por la comida y restricciones dietarias. Además, la mujer con AHF tiene niveles más elevados de cortisol de 24 h en comparación con los controles, similar a lo que ocurre con las mujeres con TCA. Un estudio que evaluó el nivel de cortisol nocturno también reportó niveles más altos en adolescentes y jóvenes atletas en amenorrea comparadas con las atletas eumenorreicas y las mujeres no atletas. Un ensayo preclínico en primates demuestra un sinergismo entre los estresores metabólicos y psicosociales, que se suman y contribuyen a la disfunción reproductiva. Los monos, al igual que las mujeres, varían en sensibilidad a la disrupción reproductiva cuando se exponen a estresores metabólicos y psicosociales. Los investigadores se refieren a los monos que responden negativamente a los estresores como “sensibles al estrés”, término que podría aplicarse de manera análoga al grupo de mujeres.
Los riesgos más importantes de la AHF incluyen: pubertad retrasada, amenorrea, infertilidad y los problemas de salud a largo plazo debidos al hipoestrogenismo. La infertilidad se debe generalmente a la anovulación, aunque algunas pacientes también pueden presentar una fase folicular prolongada o fase lútea inadecuada. La amenorrea puede ser prolongada y los riesgos asociados pueden diferir según su etiología. La falta de menstruaciones puede acompañar al descenso de peso por dietas restrictivas y, en algunos casos, indicar un TCA. Típicamente, cuanto más larga es la duración de la agresión, más tiempo llevará revertir las alteraciones menstruales y restablecer las menstruaciones normales. El riesgo crónico más importante es la pérdida de masa ósea o la imposibilidad de alcanzar el pico de masa ósea en las jóvenes. Las mujeres con amenorrea inducida por ejercicio físico, especialmente aquellas que también presentan dietas restrictivas y bajo peso, pueden presentar disminución de la masa ósea. Algunas pacientes con AHF presentan osteoporosis y fracturas, principalmente fracturas por estrés. Las fracturas por estrés repetitivas pueden ocurrir hasta en el 30% de las bailarinas de ballet y otras atletas con altos niveles de exigencia, como así también en pacientes con malos hábitos alimenticios. La etiología de estas fracturas es en parte debido a la baja masa ósea, y algunos autores consideran que también podrían deberse a un estado energético bajo que conlleva menor formación y recambio óseo, lo que favorece un estado resortivo. Esto impide la reparación del hueso y conlleva lesiones por uso excesivo. Existe escasa evidencia que avale la asociación entre AHF y pérdidas de embarazo o restricción del crecimiento intrauterino, particularmente cuando la amenorrea se asocia a TCA. Las pacientes con anorexia nerviosa (AN) presentan mayor riesgo de parto pretérmino y finalización del embarazo por cesárea. Finalmente, si bien aún se desconoce si el hipoestrogenismo prolongado se asocia a mayor riesgo cardiovascular en mujeres premenopáusicas, algunos estudios en monas premenopáusicas demostraron asociación entre la supresión de la función reproductiva y un desarrollo de ateroesclerosis acelerada en arterias coronarias.
1. Diagnóstico, diagnósticos diferenciales y evaluación
1.1. Se sugiere realizar el diagnóstico de AHF únicamente luego de descartar causas orgánicas o anatómicas de amenorrea.
Evidencia
La AHF se caracteriza por ausencia o irregularidad en las menstruaciones debido a un estímulo insuficiente o supresión del eje hipotálamo-hipófiso-ovárico (HHO) en ausencia de patología orgánica o anatómica. En este contexto se usa el término “orgánica” para los casos de amenorrea con niveles inapropiadamente bajos de gonadotrofinas en los que existe una clara causa patológica. Se debe considerar una larga lista de diagnósticos diferenciales (Tabla I). Además del embarazo, la AHF y el síndrome de ovario poliquístico (SOP) son las causas más frecuentes de amenorrea secundaria.
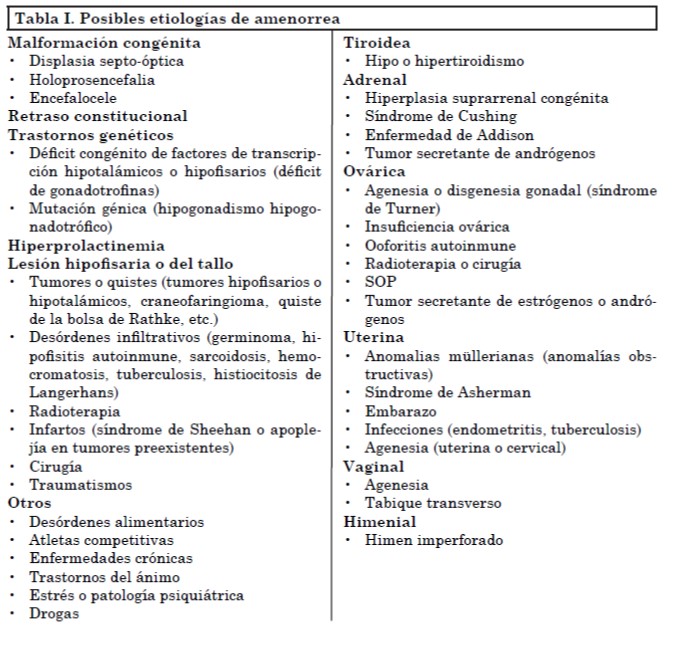
En general, existen tres causas principales de AHF: pérdida de peso y/o ejercicio vigoroso y/o estrés. Esto implica que la etiología puede variar y deberse a una combinación de factores y que incluye a mujeres con bajo peso, como así también a las normopeso. Independientemente del gatillo, la AHF se caracteriza por una anormal secreción o funcionamiento del GnRH. El déficit de energía (que puede ocurrir independientemente de los cambios en el peso corporal) es un factor crítico para las formas de AHF debidas a pérdida de peso y ejercicio. En 2003 Louks y Thuma definieron un umbral de disponibilidad de energía de 30 kcal/kg, por debajo del cual la pulsatilidad de la LH se ve afectada. Williams y cols. estimaron que una reducción experimental de energía de 471 a 810 kcal por día produce un aumento en las alteraciones menstruales. Se necesitan más estudios para determinar el punto de corte por debajo del cual las mujeres que realizan actividad física o dietas están en riesgo de desarrollar alteraciones menstruales. Es posible que este umbral varíe de un individuo a otro y que las adolescentes en crecimiento requieran aún más energía que las mayores para lograr un normal funcionamiento del eje gonadal.
Muchos estudios han reportado más alteraciones hormonales en mujeres deportistas con amenorrea comparadas con las deportistas eumenorreicas y las no deportistas. Dentro de estas alteraciones se incluyen: niveles elevados de cortisol y grelina y bajos de leptina y LH, franca elevación de la FSH durante la transición de la fase folicular a la lútea, que predispone a alteraciones en esta última (por ejemplo, secreción deficiente de progesterona), y anormalidades en el péptido Y y otras adiponectinas. Estos cambios hormonales ocurren como consecuencia de la baja energía disponible y pueden tener impacto directo sobre el eje gonadal y alterar la función menstrual.
Tanto en el grupo de pacientes adolescentes como en mujeres con AHF, existe un amplio espectro de formas de presentación y enfermedades. El espectro abarca desde aquellas que de manera consciente o inconsciente consumen una cantidad insuficiente de calorías para compensar su gasto hasta aquellas con un TCA que están severamente desnutridas. Es por ello que estas pacientes pueden oscilar entre pesos normales o severamente bajos. De la misma manera, el espectro de alteraciones menstruales incluye la eumenorrea ovulatoria, disfunciones subclínicas (eumenorrea anovulatoria, defectos de fase lútea) y amenorrea. En estas pacientes, la densidad mineral ósea (DMO) oscila entre normal y baja. La prevalencia de amenorrea inducida por ejercicio es mayor en aquellos deportes en los que la delgadez confiere una ventaja (por ejemplo, gimnasia, patinaje, corredoras, porristas). Cuando el peso es cercano al normal, la amenorrea puede revertirse durante los intervalos en que el entrenamiento disminuye o cesa, lo que sugiere que la causa de la disfunción es la energía requerida para el entrenamiento. Un reporte muestra una reversión de la amenorrea en 3 de cada 4 atletas cuando se realiza una intervención nutricional. Es importante recordar que algunas jóvenes no reanudan las menstruaciones luego de una intervención nutricional, lo que resalta el rol de los factores psicosociales subyacentes. Los trastornos del ánimo y las enfermedades clínicas pueden provocar amenorrea, y algunos comportamientos asociados (como ejercicio excesivo o alimentación restrictiva) pueden reflejar obsesiones ocultas o ansiedad. Por eso una evaluación psicosocial para excluir o confirmar desórdenes mentales es clave.
Es importante interrogar sobre toma de medicamentos como antipsicóticos, algunos antidepresivos, anticonceptivos y opioides, ya que pueden alterar los ciclos menstruales y no deben malinterpretarse dichas alteraciones con la amenorrea o las irregularidades propias de la AHF. En un estudio de 50 pacientes en tratamiento con antipsicóticos, el 90% presentaba amenorrea previa al inicio del tratamiento, mientras que el 54% reportó alteraciones menstruales y el 12%, amenorrea durante el tratamiento antipsicótico. Esto se debe a que estas drogas poseen efecto antagonista de los receptores de dopamina a nivel hipofisario, lo que disminuye el efecto inhibitorio de la dopamina sobre la secreción de prolactina (PRL). La hiperprolactinemia resultante suprime la pulsatilidad de GnRH. El uso continuo de progesterona (píldoras solo de progestágeno, inyecciones de medroxiprogesterona de depósito, SIU-levonorgestrel) puede provocar amenorrea.
1.2. Se sugiere evaluación diagnóstica para AHF en adolescentes y mujeres con intervalos menstruales persistentemente mayores a 45 días y/o aquellas que presenten amenorrea por 3 meses o más (2⊕⊕OO).
Evidencia
Las adolescentes y mujeres jóvenes con AHF generalmente se presentan con amenorrea de 6 meses o más de duración. En adolescentes, esta condición puede ser difícil de diferenciar de la inmadurez del eje típica de los primeros años luego de la menarca. Es importante notar que la AHF es la manifestación extrema del hipogonadismo hipotalámico funcional que incluye la eumenorrea anovulatoria y eumenorrea con defectos de fase lútea, y que ambas situaciones pueden asociarse a infertilidad. Estas pacientes pueden entonces presentarse con eumenorrea e infertilidad más que con amenorrea. Por último, hay que recalcar que casi la mitad de las pacientes con SOP con el fenotipo no hiperandrogénico (oligomenorrea más morfología ecográfica de ovario poliquístico) pueden tener AHF.
1.3. Se sugiere tamizaje de estresores psicosociales en las pacientes con AHF (recordar que algunas pacientes pueden hacer frente a los estresores, y la sensibilidad al estrés tiene múltiples determinantes) (2⊕⊕OO).
Evidencia
La evidencia disponible sugiere que los estímulos psicogénicos, tanto internos como externos, activan el eje HHA. Cualquier evento psicogénico (inicio escolar,tristeza profunda, pérdida de peso) que pueda generar un aumento en la secreción de cortisol provoca una adaptación metabólica. Asimismo, la adaptación metabólica suscita adaptaciones psicológicas concomitantes. Si bien la combinación de factores psicosociales y metabólicos asociados a la AHF puede variar, la vía final común es la supresión del GnRH. Los estudios sugieren que el disbalance energético sensibiliza el eje gonadal al estrés psicosocial. Tanto los estudios en animales como en humanos mostraron que un estresor actual (estrés psicosocial, baja disponibilidad energética, deseos de adelgazar), al igual que la percepción y anticipación de una amenaza, pueden provocar consecuencias endocrinas similares y alterar las menstruaciones. Los datos indican que las mujeres bajo restricción dietaria o ejercicio intenso desarrollan AHF como una respuesta adaptativa a la deficiencia crónica de energía. En dicha respuesta adaptativa, el organismo desvía la energía y otros recursos (vigilancia, emoción) a los sistemas indispensables para la supervivencia. También se minimiza la pérdida energética a través de cambios en el eje hipotálamo-hipófiso-tiroideo (se establece un patrón de hormona liberadora de tirotrofina (TRH) baja, hormona estimulante de la tiroides (TSH) normal/baja junto con triyodotironina (T3) y tiroxina (T4) disminuidas, lo que refleja un aumento del feedback negativo de las hormonas tiroideas sobre el hipotálamo y una menor respuesta de la tiroides a la TSH).
Existen dos hipótesis que explicarían el mecanismo por el cual el balance energético negativo provoca AHF. Una postula que los tejidos periféricos (hígado, tejido adiposo, páncreas, estómago, duodeno, romboencéfalo) detectan una reducción en la cantidad de recursos disponibles para oxidación (glucosa, ácidos grasos, cuerpos cetónicos) a través de aferentes humorales. Luego, se secretan múltiples hormonas y neuropéptidos que alternan la sensibilidad al feedback en el romboencéfalo. La otra hipótesis (hipótesis del contenido crítico de grasa) sugiere que se necesita un mínimo de tejido graso para el inicio del desarrollo puberal y para la preservación de la función reproductiva. Estas teorías no fueron confirmadas y no son mutuamente excluyentes, ya que la grasa corporal refleja los depósitos energéticos disponibles. Por otro lado, la reversión de una AHF asociada a terapia conductivo-conductual (TCC) reduce los niveles de cortisol y aumenta los de leptina y TSH sin provocar aumentos de peso, lo que sugiere que la reducción del estrés corrige las alteraciones neuroendocrinas y metabólicas, independientemente del peso.
1.4. Una vez establecido el diagnóstico de AHF, se sugiere informar a las pacientes sobre los posibles patrones de sangrado menstrual durante la fase de recuperación. Las menstruaciones irregulares no requieren evaluación inmediata y no excluyen el riesgo de embarazo.
Evidencia
Las mujeres en recuperación de AN, al igual que las atletas, pueden experimentar períodos de fase lútea inadecuada (con foliculogénesis alterada) mientras aumentan su ingesta calórica o disminuyen el nivel de actividad física.
Algunas pacientes pueden presentar un estado hipogonadotrófico leve que persiste varios años, que genera niveles de gonadotrofinas y esteroides sexuales más bajos que los esperados para su edad. Clínicamente, estas pacientes pueden presentar períodos menstruales largos, con fase folicular prolongada y fase lútea corta, spotting premenstrual o adelantamiento de las menstruaciones debido a una secreción inadecuada de progesterona. Un estudio demostró que los ciclos anovulatorios y/o las fases lúteas cortas eran más frecuentes en un grupo de corredoras eumenorreicas en comparación con las mujeres sedentarias. La implicancia clínica a largo plazo de estas anormalidades menstruales leves es desconocida, especialmente en lo que se refiere a salud ósea, riesgo cardiovascular y fertilidad.
2. Evaluación
2.1. En las pacientes con sospecha de AHF se recomienda realizar una historia clínica detallada haciendo hincapié en la dieta, TCA, actividad física, actitudes perfeccionistas y de gran necesidad de aprobación social, variaciones de peso, patrones de sueño, estrés, ánimo, fracturas y abuso de sustancias. También debe recabarse información sobre antecedentes familiares de TCA y trastornos reproductivos.
Evidencia
En las pacientes con sospecha de AHF es imperativo obtener datos sobre galactorrea, cefalea severa o persistente, náuseas y vómitos, cambios en la vista, sed, frecuencia y volumen miccional, todos datos que puedan sugerir la existencia de un prolactinoma u otro tumor hipofisario o intracraneal. También se deben recabar síntomas que sugieran disfunción tiroidea (tanto hipo como hipertiroidismo), síntomas de exceso de andrógenos o asociados a patologías crónicas. En las pacientes con amenorrea primaria y anosmia/hiposmia debe considerarse el síndrome de Kallman. Hay que evaluar cuadros de ansiedad y depresión y las enfermedades crónicas, ya que estas pueden asociarse a amenorrea.
Los médicos deben interrogar acerca de hábitos alimentarios y ejercicio, o cambios recientes en ellos, incluidos la presencia de atracones o purgas, cambios recientes de peso y estresores. No existe un umbral de ejercicio que genere déficit energético y amenorrea, y es importante recordar que muchos estresores en apariencia insignificantes pueden resultar mucho más disruptivos para la función reproductiva que los que se identifican fácilmente.
Los medicamentos, incluidos los antipsicóticos, antidepresivos, anticonceptivos y opioides, pueden alterar las menstruaciones. El uso crónico de drogas ilícitas es frecuentemente un marcador de estrés y malnutrición.
Se debe recabar sobre antecedentes familiares de TCA o alteraciones endocrino-reproductivas. Es importante interrogar sobre historia de aborto y complicaciones obstétricas que pueden verse de manera frecuente en mujeres con historia de desórdenes alimentarios restrictivos. Muchas alteraciones endocrinas tienen afectación familiar y pueden influir en la edad de la menarca y la función menstrual.
2.2. En una paciente con sospecha de AHF se debe descartar embarazo y realizarse un examen físico completo, incluyendo examen ginecológico (externo y, en casos seleccionados, bimanual también) para evaluar la posibilidad de etiologías orgánicas de la amenorrea (⊕⊕⊕O).
Evidencia
Un examen físico completo, incluyendo peso, talla y examen ginecológico externo y bimanual permite una evaluación adecuada para contemplar los posibles diagnósticos diferenciales que se plantean frente a una mujer con AHF. Debería evaluarse la presencia de galactorrea, hirsutismo, acné, clitoromegalia, palpación tiroidea y campo visual. Signos de lateralización podrían indicar patología intracraneal. Además de la pérdida de peso, algunas pacientes con AHF pueden presentar bradicardia, extremidades frías y manifestaciones cutáneas debidas al exceso de caroteno. Los signos de hiperandrogenismo (acné, hirsutismo, alopecia, clitoromegalia), los de hiperinsulinemia (acantosis nigricans) deberían orientar las sospechas diagnósticas hacia SOP u otra causa de exceso de andrógenos (hiperplasia suprarrenal congénita, tumores virilizantes). Ocasionalmente, las mujeres jóvenes con hiperandrogenismo severo se presentan con amenorrea, lo que refleja el efecto atrófico del estímulo androgénico sostenido sobre el endometrio.
El examen ginecológico externo puede revelar una mucosa vaginal enrojecida, lo que evidencia deficiencia de estrógenos, o una formación azulada que podría representar un himen imperforado. La examinación bimanual puede ser útil en algunos casos, por ejemplo, para descartar la existencia de masas anexiales. Esto es crítico en los casos de amenorrea primaria para descartar himen imperforado o anomalías müllerianas (vaginas acortadas y úteros rudimentarios o ausentes) o insensibilidad a los andrógenos (fondo de saco vaginal ciego). En algunos casos, dependiendo de la habilidad del médico y de la preferencia/cooperación de la paciente, podría realizarse una ecografía transabdominal o transvaginal en primera instancia, en vez de la examinación bimanual.
2.3. En adolescentes y mujeres con sospecha de AHF se recomienda obtener el siguiente laboratorio de tamizaje: subunidad beta de gonadotrofina coriónica humana, hemograma completo, ionograma, glucemia, uremia, creatininemia, hepatograma, bicarbonato y (cuando corresponda) eritrosedimentación y proteína C reactiva (⊕⊕⊕⊕).
Evidencia
La evaluación inicial con laboratorio debería comenzar con un dosaje de subunidad beta de gonadotrofina coriónica humana para descartar embarazo. En aquellas pacientes en las que se sospecha una patología crónica como causadel hipogonadismo, se debería solicitar hemograma, hepatograma, eritrosedimentación y proteína C reactiva. Un valor elevado de glucemia debería alertar al equipo tratante y solicitar hemoglobina glicosilada (HbA1c). Una elevada eritrosedimentación o proteína C reactiva sugieren estados inflamatorios crónicos. Los estudios revelan que los valores de función hepática están alterados en mujeres y adolescentes con restricciones energéticas extremas. Sin embargo, aún falta evidencia que sustente la costo-efectividad de algunas pruebas diagnósticas de tamizaje.
2.4. Como parte inicial de la evaluación endocrinológica de una paciente con AHF se recomienda dosar: TSH, T4 libre, PRL, LH, FSH, estradiol (E2) y hormona antimülleriana. Se debería dosar testosterona (To) total y sulfato de dehidroepiandrosterona (SDHEA) en pacientes con hiperandrogenismo clínico y 17-hidroxiprogesterona si se sospecha hiperplasia suprarrenal congénita.
Evidencia
Si se interpreta correctamente el panel de estudio que incluye TSH, T4 libre, PRL, FSH, LH, E2 y To total, permite detectar las principales causas de amenorrea. El patrón de los niveles hormonales es más importante que los valores absolutos. Típicamente las pacientes con AHF tienen niveles bajos o normales de LH, niveles normales de FSH (generalmente mayores que los de LH), E2 <50 pg/ml; la respuesta aguda de las gonadotrofinas a la estimulación con GnRH está conservada (aumento de 2-3 veces el valor de LH y FSH comparado con los niveles basales). No existe un punto de corte de E2 para confirmar el diagnóstico de AHF. En pacientes con niveles persistentemente bajos de E2 (<20 pg/ml), la única herramienta para diferenciar AHF de hipogonadismo gonadotrófico es la prueba de GnRH. En el hipogonadismo hipogonadotrófico, la respuesta inicial de LH es baja pero se normaliza con la terapia pulsátil prolongada con GnRH. La función tiroidea en la AHF es similar a la observada con cualquier enfermedad crónica: TSH y T4 libre en el límite normal bajo, que generalmente revierte a la normalidad cuando se recupera peso o se realiza tratamiento psicológico. La To y PRL se encuentran en el límite bajo de la normalidad.
En ausencia de signos de hiperandrogenismo, el dosaje de FSH, LH, E2, PRL, TSH y T4 libre generalmente alcanza para descartar las causas orgánicas de amenorrea. Niveles elevados de FSH y LH con E2 bajo (<20 pg/ml) orientan a insuficiencia ovárica. Niveles muy bajos o indetectables de gonadotrofinas sugieren mutaciones del gen de GnRH o causas centrales hipotalámicas/hipofisarias o tumores y lesiones infiltrativas.
La evaluación de la función tiroidea y dosaje de PRL es muy importante en las pacientes con AHF. Hay que recordar que el ejercicio, coito, estimulación del pezón, lactancia y muchas medicaciones pueden alterar los niveles de PRL. Frente a niveles bajos de TSH con niveles elevados de T4 libre, uno debería sospechar tirotoxicosis. A la inversa, niveles altos de TSH con T4 libre normal o baja deben orientar hacia hipotiroidismo clínico y subclínico, y niveles bajos de TSH con niveles bajos de T4 indican hipotiroidismo central.
A la hora de interpretar el resultado de los andrógenos, es importante estar familiarizado con los rangos de normalidad de cada laboratorio, ya que los ensayos no están estandarizados entre los diferentes centros diagnósticos. Se deberían obtener niveles de To total o libre y SDHEA para descartar etiología adrenal. Si la paciente tiene signos de virilización o niveles sustancialmente altos de SDHEA y/o testosterona, el dosaje de 17-hidroxiprogesterona podría servir como tamizaje para hiperplasia suprarrenal congénita. Niveles muy elevados de SDHEA podrían indicar un tumor adrenal. Algunas pacientes con tumores adrenales pobremente diferenciados tienen niveles más altos de DHEA que de SDHEA.
Si el profesional sospecha síndrome de Cushing, deberá solicitar cortisol libre urinario de 24 h, cortisol nocturno o prueba de supresión de dexametasona. Si se constata hipercortisolismo, se deberá repetir el dosaje para confirmar el diagnóstico. Cuando la causa de la AHF es el estrés, el aumento en el cortisol es menor que el hallado en el síndrome de Cushing y el ritmo circadiano se encuentra conservado.
2.5. Luego de descartar embarazo, se sugiere realizar una prueba de progesterona para evaluar la exposición endometrial a estrógenos y confirmar la integridad del tracto de salida (⊕⊕⊕O).
Evidencia
La ausencia de sangrado luego de una prueba de progesterona puede indicar obstrucción del tracto de salida o baja exposición endometrial a estrógenos. La respuesta a la progesterona puede brindar información adicional sobre el estado estrogénico de la paciente, sobre todo en aquellas en las que se solapa la AHF con SOP. Se puede utilizar acetato de medroxiprogesterona (5-10 mg/día por 5-10 días), acetato de noretisterona (5 mg/día por 5-10 días) o progesterona micronizada (200-300 mg/día por 10 días).
2.6. Se recomienda realizar una RMN de cerebro (con contraste y cortes de hipófisis) en mujeres con sospecha de AHF e historia de: cefaleas severas o persistentes; vómitos persistentes que no son autoprovocados; cambios en la visión, sed o ritmo diurético no atribuible a otras causas; signos neurológicos de lateralización; signos clínicos de laboratorio que sugieran déficit o exceso de hormonas hipofisarias (⊕⊕⊕O).
Evidencia
Existen pocos estudios que avalan la realización de RMN de hipófisis en ausencia de los signos clínicos descriptos previamente. Sin embargo, si no existe una clara explicación para la amenorrea (tal como AN, ejercicio intenso, pérdida de peso o TCA) debería considerarse la realización de una RMN de hipófisis.
2.7. Se sugiere obtener una DMO basal por densitometría en las adolescentes o mujeres con más de 6 meses de amenorrea, y que esta se obtenga más precozmente en pacientes con historia o sospecha de deficiencia nutricional severa, estados de déficit energético y/o fragilidad esquelética (⊕⊕⊕O).
Evidencia
El objetivo de la densitometría es identificar individuos en riesgo de fragilidad esquelética, determinar la magnitud del compromiso de la masa ósea en pacientes con fragilidad y guiar y monitorear el tratamiento. Se debe vigilar más detalladamente la ingesta nutricional en pacientes con DMO con Z-score menor o igual a -2 en cualquier sitio del esqueleto. A pesar de que los scanners típicamente proveen tanto el Z-score como el T-score, en mujeres adolescentes y premenopáusicas debería utilizarse únicamente el Z-score. El Z-score compara la DMO con controles de la misma edad, sexo y, en general, raza. Los estudios utilizan DMO corporal total al estudiar patologías crónicas, incluidos los TCA, ya que cuando esta se encuentra baja, predice el riesgo de fractura y provee información sobre la composición corporal. Sin embargo, la columna (hueso trabecular) es el sitio que más frecuentemente presenta baja densidad ósea en adolescentes y mujeres con amenorrea y también predice el riesgo de fractura, lo que lo convierte en un sitio clave para monitorear. En adolescentes mayores de 15 años y mujeres adultas con AHF, la evaluación del hueso de la cadera ofrece información adicional (hueso cortical) útil para el control de la DMO.
Las pacientes con TCA restrictivos presentan pérdida de masa ósea o inadecuada adquisición del pico de masa ósea y, por ende, alto riesgo de fractura comparadas con las pares normopeso. A pesar de que el ejercicio es beneficioso para la adquisición del pico de masa ósea en las jóvenes, en las atletas con desórdenes alimentarios y bajo peso y atletas normopeso en amenorrea, se puede evidenciar una falta de ganancia o incluso pérdida de masa ósea.
Las mujeres jóvenes con TCA presentan un riesgo de fractura 7 veces mayor, y las fracturas por estrés son un problema recurrente en las atletas que están en amenorrea. Un estado energético disminuido genera baja formación ósea y baja tasa de recambio óseo. Este bajo recambio óseo altera el mecanismo normal de reparación del daño generado por el sobreuso, lo que provoca un mayor riesgo de fractura. Las adolescentes con AN presentan bajo recambio óseo, mientras que las adultas presentan recambio óseo desacoplado. Este patrón de desacoplado es exclusivo de la deprivación nutricional. Los efectos deletéreos más importantes sobre el hueso se evidencian en mujeres que presentan déficit energético junto con déficit de estrógenos. No se evidencia daño óseo cuando el aporte energético es el adecuado para una deportista, independientemente del estatus estrogénico. Estos estudios demuestran que la pérdida de masa ósea en la AN o la amenorrea por ejercicio no es análoga a la evidenciada en la insuficiencia ovárica precoz (IOP), ya que esta última representa una forma pura de deficiencia estrogénica sin la hipercortisolemia y las otras alteraciones endocrinas.
2.8. En los casos de amenorrea primaria, sugerimos descartar anomalías de los conductos de Müller. Las opciones diagnósticas incluyen examen físico, prueba de progesterona, ecografía transvaginal o abdominal y/o RMN dependiendo del contexto y preferencias de la paciente (⊕⊕⊕O).
3. Tratamiento de la AHF
3.1. Se recomienda internación en aquellas pacientes con AHF y bradicardia severa, hipotensión, ortostatismo y/o desórdenes electrolíticos (⊕⊕⊕O).
Evidencia
Las pacientes con déficits severos de energía (como TCA restrictivos) pueden desarrollar inestabilidad hemodinámica y presentar hipotensión, bradicardia y ortostatismo. El seguimiento estricto de las pacientes con muy bajo peso está justificado, ya que la mortalidad asociada a TCA, especialmente la AN, es alta.
3.2. En adolescentes y mujeres con AHF se recomienda corregir el disbalance energético para mejorar la función del eje hipotálamo-hipófiso-gonadal. Esto requiere cambios conductuales como aumento de la ingesta calórica y/o disminución de la actividad física, lo que generalmente requiere aumento de peso (⊕⊕⊕O).
Evidencia
Es frecuente la necesidad de derivación a un nutricionista para individualizar los requerimientos nutricionales. El aumento de peso a través de la realimentación y la mejoría de la disponibilidad energética en pacientes amenorreicas con AN restauran los ciclos menstruales. Esto también se evidencia en atletas y bailarinas con AHF. La primera ovulación puede ocurrir antes que el primer sangrado menstrual, por lo que es muy importante reforzar la anticoncepción en pacientes sexualmente activas.
El enfoque debe ser siempre multidisciplinario e incluir seguimiento nutricional y apoyo psicológico para manejo del estrés y potenciar los cambios conductuales.
Algunos autores creen que la adaptación psicológica a la inadecuada ingesta calórica es un factor etiológico para los cambios metabólicos y la consiguiente disfunción reproductiva. Se producen múltiples cambios psicológicos, pero estos son reversibles. Aún no se estableció la ganancia de peso necesaria para restablecer los ciclos menstruales. Un estudio sugirió que la ganancia de peso necesaria era de 2 kg por encima del valor al cual los ciclos se detuvieron. La amenorrea puede persistir por un tiempo luego de la modificación de los factores desencadenantes. Se necesitan al menos 6 a 12 meses de peso estable para la reanudación de los ciclos. En algunos casos, aun luego de la estabilización del peso, nunca se recuperan las menstruaciones, lo que enfatiza la importancia de los factores psicológicos y el estrés en la etiología de la amenorrea.
3.3. Se sugiere soporte psicológico, como por ejemplo, TCC (⊕⊕OO).
Evidencia
Las pacientes con AHF presentan más frecuentemente actitudes disfuncionales, mayor dificultad para sobrellevar el estrés diario y mayor dependencia interpersonal. También es más frecuente que presenten antecedentes de trastornos psiquiátricos y del ánimo que el grupo de pares eumenorreicas. Un estudio aleatorizó 16 pacientes con AHF (con índice de masa corporal (IMC) normal, sin antecedentes psiquiátricos ni TCA o exceso de ejercicio) en dos grupos: uno que realizó TCC y otro que se observó durante 20 semanas. Seis de las ocho que realizaron TCC reanudaron ciclos ovulatorios contra una sola en el grupo de observación. Aún no se conoce el impacto a largo plazo de los efectos de la TCC en las secuelas que deja sobre la salud la AHF. Otras formas de psicoterapia tales como la terapia familiar o la dialéctica conductual aún no fueron evaluadas para el tratamiento de la AHF y necesitan más investigación.
3.4. Se sugiere que las pacientes con AHF no utilicen anticonceptivos orales combinados (ACO) con el solo propósito de reanudar las menstruaciones o mejorar la DMO (⊕⊕OO).
3.5. Se sugiere explicar a las pacientes con AHF que utilizan ACO para anticoncepción que los ACO pueden enmascarar el retorno espontáneo de las menstruaciones y que la pérdida de masa ósea puede continuar, sobre todo en aquellas que mantienen el déficit energético (⊕⊕OO).
Evidencia
Muchos médicos prescriben ACO en mujeres con AHF pero la mayoría de los estudios demuestran un beneficio limitado o nulo de esta intervención sobre la DMO.
En una revisión sistemática reciente se evaluó el impacto de los ACO sobre la DMO en pacientes con AHF. Los estudios reportan cambios en la DMO pero no en los valores de Z-score ni T-score o en la incidencia de fracturas. La DMO en columna lumbar, cuello femoral, región trocantérica y corporal total demostraron cambios clínicamente insignificantes luego de una mediana de 12 meses. La falta de un beneficio claro se relaciona con la persistencia de las alteraciones neuroendocrinas concomitantes, tales como el hipercortisolismo. Estos hallazgos son consistentes con el concepto de que la AH es más que una disrupción aislada del eje hipotálamo-hipófiso-gonadal. No hay estudios prospectivos publicados que evalúen el riesgo de fractura en pacientes con AHF tratadas con ACO.
3.6. En aquellas mujeres que no recuperan las menstruaciones luego de las intervenciones nutricionales, psicológicas y/o cambios en el ejercicio, se recomienda el uso durante un corto plazo de terapia transdérmica con estradiol y progesterona cíclica vía oral (no ACO o etinilestradiol) (⊕OOO).
Es importante recordar que la salud ósea puede no estar protegida con el reemplazo hormonal si el déficit nutricional y energético continúa.
3.7. Se sugiere no utilizar bifosfonatos, denosumab, testosterona o leptina para mejorar la DMO en mujeres con AHF (⊕⊕OO).
Evidencia
Cuatro estudios evaluaron el uso de bifosfonatos en mujeres premenopáusicas con AN y amenorrea. Estos estudios reportan aumentos pequeños en la DMO tanto en adolescentes como en adultas. Sin embargo, estos estudios son pequeños, utilizaban diferentes formulaciones de bifosfonatos y en diferentes protocolos y ninguno evaluó la eficacia y seguridad de estas drogas en pacientes con AHF de causa diferente a los TCA.
Es importante recordar que los bifosfonatos se depositan en el hueso y persisten en el esqueleto por muchos años. Modelos animales han demostrado la teratogenicidad de los bifosfonatos. Es debido a esto que existe preocupación sobre si la administración de bifosfonatos, aun previamente al embarazo, pueda generar movilización de las drogas desde el esqueleto, pasaje a través de la placenta y daños en el feto.
El denosumab es un anticuerpo monoclonal dirigido contra el RANK ligando que limita la resorción ósea al inhibir la maduración del osteoclasto. En mujeres posmenopáusicas con osteoporosis, el denosumab disminuyó el riesgo de fracturas y mejoró la DMO vs. placebo. Esta droga no fue probada en mujeres premenopáusicas. La exposición fetal accidental a esta droga es un riesgo teórico en mujeres en edad reproductiva, y existen estudios en primates que reportan pasaje transplacentario y riesgo teratogénico. Se necesitan más estudios en mujeres premenopáusicas, especialmente en aquellas con AHF.
Un pequeño estudio evaluó el tratamiento con leptina humana recombinante subcutánea durante 2-3 meses en mujeres con AHF secundaria a ejercicio o bajo peso. Si bien hubo algunas mejoras respecto a la función reproductiva (niveles de LH y estradiol, tasa de ovulación) en las pacientes tratadas, estas también presentaron disminución subjetiva del apetito, del peso y de la masa grasa, lo que pone en duda la utilidad de esta droga en este grupo de pacientes.
3.8. En pacientes con AHF y deseos de embarazo, luego de completados los estudios de fertilidad, se sugiere:
- Tratamiento pulsátil con GnRH como primera línea, seguido de terapia con gonadotrofinas e inducción de la ovulación si el GnRH no se encuentra disponible (⊕OOO).
- Uso cauteloso de terapia con gonadotrofinas (⊕OOO).
- Un intento de estimulación de la ovulación con citrato de clomifeno si la paciente tiene niveles suficientes de estrógenos endógenos (⊕OOO).
- No utilizar la kisspeptina o la leptina para el tratamiento de la infertilidad (⊕OOO).
- Considerar intentar con TCC, ya que este tratamiento tiene el potencial de restaurar ciclos ovulatorios y la fertilidad sin necesidad de intervenciones medicamentosas (existe un único y pequeño trabajo que sugiere la eficacia de este tratamiento, pero el riesgo de daño potencial es muy bajo, por lo que podría utilizarse) (⊕⊕OO).
Evidencia
La administración de GnRH o gonadotrofinas exógenas sería eficaz para inducir la ovulación y lograr el embarazo en pacientes con AHF. La terapia con GnRH pulsátil sería el tratamiento ideal, ya que genera ciclos ovulatorios más fisiológicos, con respuesta monofolicular y mínimo aumento del riesgo de embarazo múltiple. Sin embargo, el GnRH no se encuentra disponible actualmente en los Estados Unidos. Las mujeres con AHF podrían requerir administración de LH tanto como FSH para una respuesta óptima. Schoot y cols. observaron una respuesta estrogénica inadecuada en pacientes tratadas con FSH recombinante sin LH, lo que sugiere que la acción de la LH es fundamental en quienes tienen niveles endógenos de esta.
No existen trabajos aleatorizados que hayan evaluado el citrato de clomifeno para el tratamiento de la infertilidad en pacientes con AHF. La mayoría de las series no avalan su uso, ya que no se espera una respuesta exitosa en estas pacientes. Una serie de casos sugiere que un tratamiento más prolongado sería más exitoso que el de cinco días, utilizado usualmente en la práctica diaria. Djurovic y cols. reportan que un tratamiento de 10 días con clomifeno indujo la menstruación en 9 de 17 pacientes con AN que habían recuperado peso pero no la función menstrual.
Algunos investigadores proponen el tratamiento con kisspeptina para restablecer la pulsatilidad de la LH y la función gonadal en pacientes con AHF, pero aún se necesitan más estudios que evalúen los usos terapéuticos de dicha sustancia, que no se encuentra disponible para uso clínico todavía.
3.9. Se sugiere inducción de la ovulación únicamente en mujeres con AHF que tengan un IMC de al menos 18,5 kg/m2 y únicamente luego de intentar normalizar el balance energético debido al riesgo de pérdida de embarazo, parto pretérmino, restricción del crecimiento intrauterino y cesárea por bajo peso (⊕⊕OO).
Evidencia
Un IMC de 18,5 es el límite por debajo del cual se considera que una mujer tiene bajo peso y, posiblemente, desnutrición. Es por eso que se considera este límite como el mínimo que una mujer necesita para optimizar sus probabilidades de fertilidad y, cuanto más alto, mejor. Existe información que sugiere que un IMC extremadamente bajo se asocia a mayor riesgo de resultados obstétricos desfavorables. Un estudio de caso-control encontró que las pacientes con IMC <20 tienen un riesgo cuatro veces mayor de parto pretérmino luego de ajustar por otras variables conocidas. La desnutrición también se asocia con bajo peso al nacer. Existe información limitada que sugiere mayor riesgo de muerte fetal como consecuencia de la AHF, particularmente en pacientes con TCA. Las pacientes con AN también tienen mayor riesgo de parto pretérmino y finalización del embarazo por cesárea.
* Médica tocoginecóloga. Becaria de perfeccionamiento de Ginecología Infantojuvenil, Hospital Italiano de Buenos Aires

