Alta frecuencia de insulinorresistencia en adolescentes con síndrome de ovario poliquístico (SOP) independientemente del peso corporal
Trabajo Original • Freire, Analía; Rubino, Cristabel; Arcari, Andrea; Ballerini, María Gabriela;
Escobar de Lázzari, María Eugenia; Gryngarten, Mirta; Ropelato, María Gabriela *
RESUMEN
Introducción: la asociación de insulinorresistencia (IR) y DBT II en adultas con SOP está bien establecida. Sin embargo, son escasos los estudios sobre el diagnóstico de IR basado en la prueba oral de tolerancia a la glucosa (PTOG) en adolescentes con SOP. La IR puede vincularse con el mayor riesgo cardiovascular de estas pacientes, el que también se afecta por el aumento del estado proinflamatorio, que puede evaluarse mediante biomarcadores como la proteína C reactiva ultrasensible (PCRus). Por otro lado, existe escasa información en adolescentes en etapas iniciales del SOP acerca del estado proinflamatorio y su asociación con la IR.
Objetivos: evaluar la presencia de IR en adolescentes con SOP mediante PTOG y comparar el perfil endocrino-metabólico y proinflamatorio en presencia o no de IR.
Pacientes y métodos: estudio prospectivo, de corte transversal. Se incluyeron pacientes con diagnóstico de SOP >2,5 años de edad ginecológica, de acuerdo con los criterios diagnósticos de AES. Se realizó PTOG midiendo glucemia e insulina cada 30 min. durante 2 h. En condiciones basales se determinó perfil androgénico (androstenediona, testosterona total y testosterona libre), perfil lipídico (Col T, HDL, LDL, triglicéridos) y PCRus. Se consideró IR a la presencia de un pico de insulina >150 μU/ml y/o a un nivel de insulina >75μU/ml a las 2 h. Por el IMC, las pacientes se clasificaron como normopeso o sobrepeso/obesidad. Los datos se expresan en media y ESM.
Resultados: se incluyeron 23 adolescentes con SOP, edad 16,8 ± 0,4 años (EG 4,76 ± 0,38 años). En la PTOG se encontró IR en el 74% (n=17) de las pacientes. Seis de ellas presentaban normopeso, 7 sobrepeso y 4 obesidad. Considerando la clasificación según IMC, el 50% de las pacientes con normopeso presentó IR, mientras que en todas las pacientes con sobrepeso u obesidad se observó IR. No se encontraron diferencias en el nivel de andrógenos entre aquellas pacientes con IR o sin ella. En el grupo de pacientes con sobrepeso u obesidad, a pesar de que todas presentaban IR, la dislipidemia no fue frecuente, siendo el único hallazgo niveles de HDL <40 mg/dl en solo 3 de 11 pacientes, mientras que en todas las pacientes con normopeso el perfil lipídico fue normal. La concentración de PCRus fue cuatro veces más elevada en pacientes con IR y sobrepeso u obesidad que en aquellas con normopeso en presencia o no de IR (p<0,005).
Conclusiones: las adolescentes con SOP presentan elevada frecuencia de IR, aun aquellas con peso normal, lo que sugiere alteraciones fisiopatológicas en la señalización del receptor de insulina intrínsecas al síndrome. La asociación de SOP con sobrepeso u obesidad se acompañó de un mayor estado proinflamatorio pero sin asociarse con frecuencia a dislipidemia.
Este estudio demuestra que la PTOG pone de manifiesto cambios en la sensibilidad a la insulina en pacientes en etapas tempranas del SOP e independientemente del peso y del grado de hiperandrogenismo. La presencia de sobrepeso/obesidad en estas pacientes debería orientar a incluir además la evaluación de factores de riesgo cardiovascular y establecer precozmente medidas preventivas para evitarlos.
SUMMARY
Introduction: The association of Insulin Resistance (IR) and DBT II in adults with PCOS is well established in the literature. However, there is scarce information about diagnosis of IR in adolescents with PCOS based by Oral Glucose Tolerance Test (OGTT). Besides, IR may be associated with increased cardiovascular risk and pro-inflammatory state (mainly evaluated by ultrasensitive C-reactive protein: usCRP) in adolescents with PCOS.
Objectives: To evaluate the presence of IR in adolescents with PCOS by OGTT and to compare the endocrine-metabolic and pro-inflammatory profiles in the presence or absence of IR.
Patients and methods: A prospective, cross-sectional study was conducted. Patients with a diagnosis of PCOS >2.5 years of gynecological age (GA) were included according to AES criteria. They underwent a standard 75-g OGTT where glucose and insulin were measured every 30 min during 2 hs. At baseline, androgens (total and free testosterone, androstenedione, SHBG), lipids (total cholesterol, HDL, LDL, tryglicerides) and usPCR were measured. IR was defined as a peak insulin >150 μU/mL and/or 2-hour insulin level of >75 μU /mL. Patients were classified as normal-weight or overweight/obese according their BMI. Data are expressed as mean and ESM.
Results: 23 adolescents with PCOS were included (16.8 ± 0.4 years and GA: 4.76 ± 0.38 years). IR was found in 74% (n=17) of the patients by OGTT. Six of them had normal weight, 7 were overweight and 4 were obese. According to BMI, 50% of normal-weight patients presented IR, whereas IR was observed in all overweight /obese patients. No differences in androgens levels were found among those patients with or without IR. In the group of overweight/ obese patients, dyslipidemia was not frequent, although all had IR. Only 3 of 11 patients presented HDL levels <40 mg/dL. The lipid profile was normal in patients with normal-weight (with or without IR). Patients with IR and overweight/obesity presented usCRP levels four times higher than in those with normal-weight (p<0.005).
Conclusions: Adolescents with PCOS present high frequency of IR, even those with normal weight, suggesting that alterations in insulin receptor signaling could be intrinsic to the syndrome. Pro-inflammatory state is getting worse in PCOS patients with overweight or obesity but in them dyslipidemia is not frequent.
This study, using OGTT, demonstrates insulin sensitivity changes in patients at the early stages of PCOS, regardless their body weight and degree of hyperandrogenism.
Overweight and obese PCOS patients should be evaluated about cardiovascular risk factors and preventive actions should be established to avoid them.
INTRODUCCIÓN
El síndrome de ovario poliquístico (SOP) es una de las endocrinopatías más comunes en mujeres, que afecta al 5-10% de aquellas en edad reproductiva1. En adolescentes, el SOP es la principal causa de alteraciones menstruales e hiperandrogenismo2. Si bien fue descripto hace más de 80 años, aún no se conocen con certeza todos los mecanismos fisiopatológicos involucrados. A pesar de que algunos estudios jerarquizan, entre ellos, el incremento de los pulsos de la hormona luteinizante (LH)3, otros proponen el origen en la IR o en la esteroideogénesis ovárica anormal4,5. Aunque todos ellos podrían coexistir en esta entidad constituyendo una trama aún no aclarada de disregulación endocrino-metabólica. Se consideran relevantes para el diagnóstico de SOP los niveles de testosterona, testosterona libre y Δ4 androstenediona, pero se encuentran en estudio otras vías esteroideogénicas descriptas recientemente que podrían tener implicancias funcionales en este síndrome6.
Por estudios poblacionales se han establecido implicancias a largo plazo en la salud de las mujeres que padecen SOP, debido tanto a los efectos del hiperandrogenismo como a los trastornos metabólicos asociados. El SOP presenta un impacto deletéreo sobre el metabolismo en general. En mujeres adultas se ha establecido la frecuente asociación del SOP con síndrome metabólico, resistencia a la insulina, obesidad abdominal, diabetes tipo 2, dislipidemia, hipertensión, todos ellos factores que predisponen a la enfermedad cardiovascular. Por otro lado, también se ha asociado a la hiperplasia endometrial que predispone al cáncer de endometrio7.
Dada la alta prevalencia del SOP, resulta relevante para la salud pública la realización de estudios de investigación clínica que evalúen la presencia de IR y los factores de riesgo cardiovascular en estas pacientes8,9. La presencia de IR se ha relacionado con el daño endotelial y ateroesclerosis temprana10. La prevalencia de IR se ha estimado en el 64% y se evalúa sobre la base del incremento del HOMA-IR (Homeostasis Model Asssessment, calculado por determinaciones basales de glucemia e insulina)9. En nuestro medio, este marcador de IR se ha determinado con un valor de corte ≥2,6 en adolescentes11. Sin embargo, el estándar más aceptado para la evaluación de la IR es la prueba oral de tolerancia a la glucosa (PTOG)12. Esta prueba está recomendada en casos de SOP con obesidad o antecedentes familiares de diabetes por las guías desarrolladas en consenso de expertos para el asesoramiento de riesgo cardiovascular13.
Si bien está claramente recomendada en el SOP la determinación del perfil lipídico básico, el riesgo cardiovascular se vincula al aumento del estado proinflamatorio, el cual puede además evaluarse por marcadores inflamatorios de bajo grado. La proteína C reactiva ultrasensible (PCRus) es indicadora de disfunción endotelial, que se relaciona con la ateroesclerosis temprana14. En este contexto, son escasos los estudios efectuados en pacientes con SOP que analizan la asociación entre IR y marcadores de disfunción endotelial y aún no han sido realizados en adolescentes con SOP que se encuentran en etapas tempranas del síndrome15.
Por todo lo expuesto sobre las alteraciones en el eje hipófiso-ovárico, la IR y la enfermedad cardiovascular en el SOP, consideramos que las adolescentes con SOP, en estadios tempranos del síndrome, podrían presentar factores de riesgo metabólico y cardiovascular identificables y el conocimiento de ellos permitiría ayudar a individualizar medidas preventivas y terapéuticas.
OBJETIVOS
- Evaluar la presencia de IR en adolescentes con SOP mediante PTOG.
- Comparar diferencias entre pacientes con SOP con IR o sin ella en cuanto al índice de masa corporal (IMC) y en el perfil endocrino-metabólico (grado de hiperandrogenismo, dislipidemia).
- Evaluar la asociación entre la IR, el exceso de peso (según el IMC) y el estado proinflamatorio por niveles de PCRus.
METODOLOGÍA
Diseño
Se llevó a cabo un estudio analítico, prospectivo, de corte transversal.
Pacientes
Se estudiaron adolescentes con SOP de edad ginecológica >2,5 años, diagnosticadas según los criterios del consenso de la Asociación de Exceso de Andrógenos16: a) presencia de hiperandrogenismo clínico y/o bioquímico; b) disfunción ovárica (oligoanovulación y/o morfología de ovarios poliquísticos por ecografía); c) exclusión de otras patologías que cursan con exceso de andrógenos. Se excluyeron pacientes con alteraciones renales, hepáticas y aquellas que se encontraran bajo tratamiento con anticonceptivos orales o fármacos que afectaran el metabolismo lipídico o glucídico, y pacientes que fueran fumadoras, consumieran drogas o alcohol en exceso.
El estudio fue aprobado por el Comité de Ética en Investigación del Hospital de Niños Dr. Ricardo Gutiérrez. Todas las participantes dieron su consentimiento para participar del estudio.
En todas las pacientes, se evaluó peso, talla, circunferencia de cintura, ciclo menstrual y score de hiperandrogenismo (Ferriman y Gallwey). Se definió sobrepeso u obesidad teniendo en cuenta los percentilos 85 y 95 establecidos para la población juvenil argentina17. El perfil hormonal, proinflamatorio y lipídico se evaluó en condiciones basales en un día al azar en aquellas pacientes que se encontraban en amenorrea o en fase folicular temprana en las pacientes que presentaban oligomenorrea. En todas las pacientes se realizó PTOG midiendo insulinemia y glucemia basal y durante dos horas cada 30 minutos posteriores a 75 g de glucosa por vía oral. La concentración sérica de LH, hormona foliculoestimulante (FSH), estradiol, testosterona total, insulina y prolactina se determinó utilizando inmunoensayos automatizados (ECLIA, Cobas e411). Los niveles séricos de globulina transportadora de hormonas sexuales (SHBG) y sulfato de dehidroepiandrosterona (SDHEA) se determinaron por ICMA (Immulite 2000) y los de androstenediona, por RIA. Se determinaron por cálculo los niveles séricos de testosterona libre utilizando la concentración de testosterona total y SHBG. Se determinó proteína-C reactiva ultrasensible (PCRus) como marcador del perfil proinflamatorio y perfil lipídico: triglicéridos (TGL), colesterol total (CT) y sus fracciones HDL y LDL (Cobas 6000).
Consideraciones diagnósticas en el perfil androgénico
Para la interpretación de los resultados del perfil androgénico se utilizaron los valores de referencia obtenidos en nuestro laboratorio con 250 controles sanos. Para la testosterona total en fase folicular temprana se consideró normal hasta 50 pg/ml; para androstenediona, hasta 300 pg/ml y para testosterona libre, hasta 24 pmol/l.
Consideraciones diagnósticas en el aspecto metabólico
Según la sugerencia de la Sociedad Argentina de Pediatría se clasificó a las pacientes según su estatus de peso corporal en normopeso cuando el IMC fue inferior al percentilo 85 en las tablas del National Center for Health Statistics (NCHS). Se clasificó a las pacientes en la categoría sobrepeso cuando el IMC fue superior al percentilo 85 y menor al 95, y obesidad cuando el IMC fue superior al percentilo 9517.
Se consideró IR cuando el máximo valor de insulinemia fue mayor a 150 μUI/ml o el valor de insulina fue mayor a 75 μUI/ml a los 120 minutos17. Con los valores de glucemia e insulinemia en ayuno se calculó el índice HOMA-IR. Se utilizaron como referencia los valores normales previamente establecidos por nuestro grupo de trabajo en adolescentes: insulinemia en ayuno ≤17 μUI/ml, HOMA-IR ≤2,611.
Se consideró dislipidemia cuando uno o más de los siguientes parámetros estuviera por fuera del valor deseable para la población juvenil: CT >200 mg/dl, LDL >130 mg/dl, TGL >150 mg/dl, HDL <40 mg/dl11,18.
Análisis estadístico
Los resultados se expresan en media ± ESM. Se realizó prueba de MannWhitney para evaluar diferencia de media entre grupos. Se realizó análisis de regresión simple o múltiple según correspondiera para determinar la posible asociación de los niveles de andrógenos con el estado endocrino-metabólico y del nivel de PCRus con el estado de resistencia a la insulina y alteraciones del peso corporal. Se consideró significativa una p<0,05.
RESULTADOS
Se incluyeron 23 adolescentes con SOP, edad cronológica 16,8 ± 0,4 años y edad ginecológica (EG) de 4,76 ± 0,38 años. En el grupo, 12 (53%) pacientes presentaron IMC normal y 11 pacientes presentaron aumento del IMC en rango de sobrepeso/obesidad (30% sobrepeso y 17% obesidad).
El hiperandrogenismo clínico expresado por hirsutismo estuvo presente en el 87% y el acné en cara y tronco, en el 65% del grupo. El score de Ferriman y Gallwey no se pudo valorar objetivamente dado que la mayoría de las pacientes estaba utilizando diferentes técnicas depilatorias, lo que modifica el grado de hirsutismo.
En la PTOG se encontró IR en el 74% de las pacientes (17 de 23 pacientes) aunque de ellas solo 8 (35%) tenían acantosis en el examen físico. En la dinámica de secreción de insulina se observó que en 10 de las 17 pacientes con IR los niveles de insulina a los 30 minutos eran >150 μUI/ml y en 15 de las 17 pacientes los niveles de insulina persistían sin descender al punto de corte de 75 μUI/ml a los 120 minutos de la PTOG, siendo este último criterio de IR el único presente solo en 2 pacientes (Figura 1).
Entre las 17 pacientes con IR, según el IMC, 6 presentaban normopeso, 7 sobrepeso y 4 obesidad. Es importante destacar que se encontró IR en el 50% de las pacientes con normopeso del grupo total, mientras que el hallazgo de IR se extendió a todas las pacientes con sobrepeso u obesidad del grupo.
Los niveles de glucemia fueron normales en todas las pacientes durante la PTOG. Considerando otras variables clínicas y de laboratorio, ninguna de las pacientes cumplió criterios para el diagnóstico de síndrome metabólico según el ATP III. Solo 5 pacientes presentaron circunferencia de cintura >88 cm, 3 de ellas con IMC sobrepeso y 2 con obesidad.
En el grupo de pacientes con sobrepeso u obesidad, a pesar de que todas presentaban IR, la dislipidemia no fue frecuente, siendo el único hallazgo niveles de HDL <40 mg/dl en solo 3 de 11 pacientes, mientras que en todas las pacientes con normopeso con IR o sin ella, el perfil lipídico fue normal.
El valor de HOMA fue >2,6 en 13 de las 17 pacientes con IR, pero fue menor a dicho valor en todas las pacientes sin IR. Por lo tanto, el HOMA presentó sensibilidad del 76% y especificidad del 100% para detectar IR. La determinación de insulina basal fue normal en todas las pacientes sin IR, pero los niveles >17 μUI/m se encontraron en 7 de las 17 pacientes con IR (sensibilidad del 40% para el diagnóstico de IR).
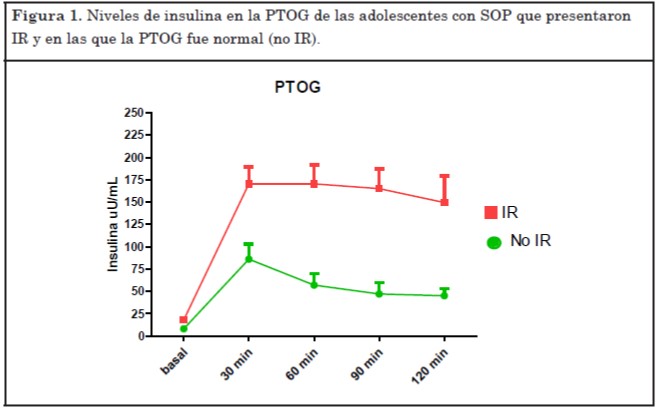
En nuestro grupo con SOP, observamos que el hiperandrogenismo bioquímico estuvo presente en 19 de las 23 adolescentes (83%). El andrógeno elevado con mayor frecuencia fue la testosterona libre (80%), la testosterona total se encontró elevada en 12 (50%) y la androstenediona, en 14 pacientes, siendo este último el único andrógeno elevado solo en una paciente.
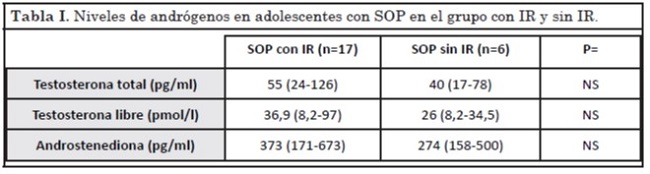
En la Tabla I se presentan las medidas de resumen para los niveles de andrógenos evaluados. En el análisis estadístico comparativo no se encontraron diferencias significativas en el grado de hiperandrogenemia entre el grupo de pacientes con IR y sin ella. Sin embargo, se observó una correlación positiva y significativa entre los niveles de testosterona libre e insulinemia en ayuno (r=0,52, p<0,05).
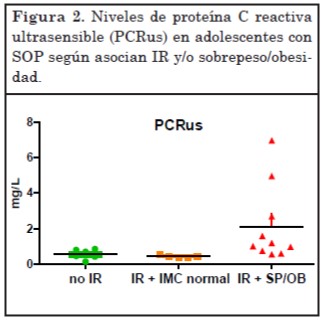
En el análisis comparativo entre los niveles de PCRus del grupo con IR y sin ella no se alcanzan diferencias significativas a nivel estadístico. Sin embargo, considerando al sobrepeso u obesidad como un subgrupo, la concentración de PCRus fue cuatro veces más elevada en pacientes con IR y sobrepeso u obesidad que en aquellas con normopeso en presencia o no de IR (p<0,005) (Figura 2).
DISCUSIÓN
El presente estudio demostró, utilizando una prueba de referencia como la prueba de tolerancia oral a la glucosa, que en las etapas tempranas del SOP, en la adolescencia, la resistencia a la insulina es un hallazgo frecuente. Esta condición se observó en forma más prevalente en adolescentes con SOP y sobrepeso u obesidad pero también en el 50% de las adolescentes SOP con normopeso. Sin embargo, no se diagnosticaron en esta cohorte de adolescentes SOP trastornos metabólicos más severos como intolerancia a la glucosa, diabetes mellitus tipo 2 o síndrome metabólico.
Es bien conocido que el SOP se asocia con sobrepeso y obesidad19. Sin embargo, la prevalencia de estas condiciones en pacientes con SOP es muy variable en relación con los grupos étnicos y la edad de las poblaciones estudiadas. La proporción de sobrepeso en mujeres adultas con SOP (IMC entre 25 a 30 kg/m2) varía entre el 10% en un estudio de Italia y el 37% en un estudio en Kuwait, con valores intermedios del 15% y 19% en Australia y EE.UU. respectivamente. En adolescentes, la proporción fue del 18% y 22% en dos estudios de EE.UU. La proporción de obesidad en adultas también es muy variable con relación al país de origen; siendo del 26% en Pakistán pero del 67% y 72% en Australia y EE.UU. respectivamente19. Nuestro estudio, aunque con una muestra pequeña de adolescentes con SOP, mostró el 30% de sobrepeso y el 17% de obesidad. Es decir, la relación entre la frecuencia de sobrepeso y obesidad en adolescentes es inversa cuando se compara con la población adulta. Esta proporción, sin embargo, es superior a la registrada en población normal; el Ministerio de Salud de la Argentina reportó en 2013 una prevalencia de sobrepeso del 15% y de obesidad del 5% en mujeres adolescentes de 15 a 20 años20. Si bien se postula en la literatura que a estas edades tempranas el SOP se manifiesta principalmente como un desorden hiperandrogénico y con trastornos del eje ovárico, resulta importante entonces destacar que la población de adolescentes con SOP presenta con mayor frecuencia que las adolescentes eumenorreicas asociación con sobrepeso u obesidad, lo que complica metabólicamente aún más el cuadro y debe ser tenido en cuenta por sus consecuencias a largo plazo.
La prevalencia de IR en pacientes con SOP es también elevada, y aún más si se asocia a obesidad. Sin embargo, diferentes trabajos muestran un rango variable, dependiendo también del parámetro que se toma para el diagnóstico. En adultas con SOP, trabajos previos describen una prevalencia de IR del 44 al 70% utilizando índices subrogantes de insulina como el HOMA-IR21. Sin embargo, es conocido que estos índices que se obtienen en condiciones basales son poco sensibles para la detección de esta condición, si bien son muy importantes cuando se utilizan en estudios epidemiológicos con grandes series de pacientes. Por otro lado, los valores de estos índices que se presentan como valores de corte para indicar IR e insulinosensibilidad son muy variables en los distintos trabajos publicados, producto también de la variabilidad entre los ensayos para medir concentraciones plasmáticas de insulina.
La aplicación de pruebas funcionales que frente a la sobrecarga de glucosa ponen de manifiesto la capacidad de síntesis y secreción de insulina en un paciente determinado refleja con mayor sensibilidad y especificidad el grado de sensibilidad a la insulina. Estos han sido menos utilizados en la literatura dado que son métodos más invasivos y se deben realizar en centros especializados y aún más si se trata de población infanto-juvenil.
En nuestro estudio, hemos detectado alta frecuencia de resistencia a la insulina en respuesta a la PTOG en adolescentes con SOP. Esta se encontró en todas las pacientes con sobrepeso y obesidad y en la mitad de las pacientes con normopeso.
El mecanismo molecular de resistencia a la insulina en SOP se propone como alteraciones de la fosforilación del receptor de insulina en las que se encuentra aumentada la fosforilación en residuos serina, por una posible activación de una serin-quinasa del receptor de insulina y de los sustratos del receptor de insulina 1 (IRS-1), en lugar de fosforilación de residuos tirosina21. Esto se traduce en una disminución de la activación de la vía PI3-K mediada por insulina y una disminución de la respuesta normal a la insulina en la célula target (siendo estas las células musculares, hepáticas y del tejido adiposo pero no así en las células del folículo ovárico). Se generaría de este modo un aumento compensatorio de insulina por las células β del páncreas y las alteraciones del metabolismo de la glucosa se desarrollarían cuando la célula β comienza a perder la capacidad de satisfacer los requerimientos provocados por la IR21.
La frecuencia de insulinemia elevada en ayuno en adolescentes SOP considerando nuestro valor de corte de 17 μUI/ml para adolescentes fue de 7/17, sensibilidad del 41%, todas ellas con sobrepeso/obesidad. El HOMA-IR fue >2,6 (elevado) en 13/17 pacientes (sensibilidad del 74%). En nuestro estudio, el HOMA-IR fue menos sensible que la PTOG para detectar IR pero fue mejor indicador que la insulinemia basal. Creemos que el HOMA-IR es una buena herramienta de screening en la población de adolescentes con SOP, dado que todas las pacientes con HOMA >2,6 confirmaron la IR en la PTOG. Sin embargo, cuando los valores de HOMA-IR son normales, sería necesario realizar la PTOG para definir si el SOP está acompañado o no por IR para establecer una prevención temprana de factores de aumento de riesgo cardiovascular .
La dislipidemia más prevalente en adultas con SOP que está presente en el 70% de las pacientes es la hipertrigliceridemia y los bajos niveles de HDL colesterol y lipoproteínas LDL pequeñas y densas típicas del estado de insulinorresistencia22. Sin embargo, en nuestro grupo de adolescentes la frecuencia de dislipidemia fue baja.
El diagnóstico de hiperandrogenismo bioquímico en mujeres sintomáticas con SOP se basa en la documentación de andrógenos séricos elevados utilizando un ensayo confiable con los valores normales bien definidos16. Las mediciones de testosterona total y/o libre han sido las más recomendadas para documentar hiperandrogenemia16,23. En nuestra cohorte de adolescentes, el mejor marcador de hiperandrogenemia fue la testosterona libre que se mostró elevada en el 80% de los casos documentando así la hiperandrogenemia y contribuyendo al diagnóstico del síndrome, sin embargo, la androstenediona fue el único andrógeno elevado en una adolescente y en 4 adolescentes el diagnóstico de hiperandrogenismo fue solo clínico con presencia de hirsutismo y acné. Es importante destacar entonces que se solicite el perfil androgénico completo incluyendo testosterona con SHBG para poder determinar la testosterona libre.
La asociación del hiperandrogenismo con la hiperinsulinemia en SOP ha sido descripta hace más de dos décadas por el grupo de Dunaif A.24. En nuestro trabajo, el grado de hiperandrogenemia (evaluada por el nivel de testosterona total, testosterona libre o androstenediona) no mostró una diferencia significativa entre los grupos con IR o sin ella. Por lo tanto, de este grupo de adolescentes se deduce que el grado de hiperandrogenemia en sí mismo no es un indicador para sospechar la IR
La PCR es un reactante de fase aguda sintetizado en el hígado en respuesta a interleuquina 6 y TNFα. Varios estudios epidemiológicos han demostrado que la PCR, un marcador del estado de inflamación crónica de bajo grado como la obesidad, es útil en la predicción de infarto de miocardio, accidente cerebrovascular, enfermedad arterial periférica y muerte súbita en la población general. Se ha demostrado que las mujeres adultas con SOP presentan niveles elevados de PCRus comparadas con mujeres adultas eumenorreicas apareadas por IMC25.
En nuestra cohorte de adolescentes con SOP e IR y aumento del IMC, el marcador de inflamación PCRus estuvo elevado casi 4 veces respecto de las adolescentes con SOP con normopeso en presencia o ausencia de IR. Es decir, que este marcador de estado proinflamatorio en etapas tempranas del síndrome se relacionó más con el aumento de peso que con el estado de resistencia a insulina. Aunque sería necesario ampliar este estudio con mayor número de pacientes para enfatizar estos resultados, ya se han hallado resultados similares en otras poblaciones26.
CONCLUSIONES
- En este estudio se encontraron cambios en la sensibilidad a la insulina en adolescentes en etapas tempranas del SOP con alta frecuencia, independientemente del peso corporal y del grado de hiperandrogenismo.
- La elevada frecuencia de IR en adolescentes con SOP, aun en aquellas con peso normal, sugiere alteraciones fisiopatológicas en la señalización del receptor de insulina intrínsecas al síndrome.
- La asociación de SOP con sobrepeso u obesidad se acompañó de un mayor estado proinflamatorio sin asociarse con frecuencia a dislipidemia. Sin embargo, el hallazgo de mayores niveles de PCRus en pacientes con SOP con sobrepeso/obesidad orienta a establecer precozmente medidas preventivas para reducir en ellas el riesgo cardiovascular a futuro.
REFERENCIAS
- Franks S. Polycystic ovary syndrome. N Engl J Med 1995 Sep 28; 333(13):853-61.
- West S, Lashen H, Bloigu A, Franks S, Puukka K, Ruokonen A y cols. Irregular menstruation and hyperandrogenaemia in adolescence are associated with polycystic ovary syndrome and infertility in later life: Northern Finland Birth Cohort 1986 study. Hum Reprod 2014 Oct 10; 29(10):2339-51.
- Ropelato MG, Rudaz MC, Escobar ME, Bengolea SV, Calcagno ML, Veldhuis JD y cols. Acute effects of testosterone infusion on the serum luteinizing hormone profile in eumenorrheic and polycystic ovary syndrome adolescents. J Clin Endocrinol Metab 2009 Sep; 94(9):3602-10.
- Gilling-Smith C, Story H, Rogers V, Franks S. Evidence for a primary abnormality of thecal cell steroidogenesis in the polycystic ovary syndrome. Clin Endocrinol (Oxf) 1997 Jul; 47(1):93-9.
- Carmina E, Bucchieri S, Mansueto P, Rini G, Ferin M, Lobo RA. Circulating levels of adipose products and differences in fat distribution in the ovulatory and anovulatory phenotypes of polycystic ovary syndrome. Fertil Steril 2009 Apr; 91(4 Suppl):1332-5.
- Saito K, Matsuzaki T, Iwasa T, Miyado M, Saito H, Hasegawa T y cols. Steroidogenic pathways involved in androgen biosynthesis in eumenorrheic women and patients with polycystic ovary syndrome. J Steroid Biochem Mol Biol 2016 Apr; 158:31-7.
- Franks S, McCarthy MI, Hardy K. Development of polycystic ovary syndrome: involvement of genetic and environmental factors. Int J Androl 2006 Feb; 29(1):278-85.
- Carmina E. Cardiovascular risk and events in polycystic ovary syndrome. Climacteric 2009; 12 Suppl 1:22-5.
- DeUgarte CM, Bartolucci AA, Azziz R. Prevalence of insulin resistance in the polycystic ovary syndrome using the homeostasis model assessment. Fertil Steril 2005 May; 83(5):1454-60.
- Dokras A. Cardiovascular disease risk factors in polycystic ovary syndrome. Semin Reprod Med 2008 Jan; 26(1):39-44.
- Ballerini MG, Bergada I, Rodriguez ME, Keselman A, Bengolea VS, Pipman V y cols. Insulin level and insulin sensitivity indices among healthy children and adolescents. Arch Argent Pediatr 2016 Aug 1; 114(4):329-36.
- Reaven GM, Brand RJ, Chen YD, Mathur AK, Goldfine I. Insulin resistance and insulin secretion are determinants of oral glucose tolerance in normal individuals. Diabetes 1993 Sep; 42(9):1324-32.
- Wild RA, Carmina E, Diamanti-Kandarakis E, Dokras A, Escobar-Morreale HF, Futterweit W y cols. Assessment of cardiovascular risk and prevention of cardiovascular disease in women with the polycystic ovary syndrome: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome (AE-PCOS) Society. J Clin Endocrinol Metab 2010 May; 95(5):2038-49.
- Verit FF. High sensitive serum C-reactive protein and its relationship with other cardiovascular risk factors in normoinsulinemic polycystic ovary patients without metabolic syndrome. Arch Gynecol Obstet 2010 Jun; 281(6):1009-14.
- Orio F, Jr., Palomba S, Cascella T, De SB, Di BS, Russo T y cols. Early impairment of endothelial structure and function in young normal-weight women with polycystic ovary syndrome. J Clin Endocrinol Metab 2004 Sep; 89(9):4588-93.
- Azziz R, Carmina E, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Futterweit W y cols. Positions statement: criteria for defining polycystic ovary syndrome as a predominantly hyperandrogenic syndrome: an Androgen Excess Society guideline. J Clin Endocrinol Metab 2006 Nov; 91(11):4237-45.
- Subcomisión de Epidemiología y Comité de Nutrición. Consenso sobre factores de riesgo de enfermedad cardiovascular en pediatría. Arch Argent Pediatr 2005; 103(3):262-81.
- Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA 2001 May 16; 285(19):2486-97.
- Fauser BC, Tarlatzis BC, Rebar RW, Legro RS, Balen AH, Lobo R y cols. Consensus on women’s health aspects of polycystic ovary syndrome (PCOS): the Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group. Fertil Steril 2012 Jan; 97(1):28-38.
- Sobrepeso y obesidad en niños y adolescentes. Orientaciones para su prevención, diagnóstico y tratamiento en Atención Primaria de la Salud. Ministerio de Salud de la Nación, Buenos Aires 1ra Edición. 2013.
- Diamanti-Kandarakis E, Dunaif A. Insulin resistance and the polycystic ovary syndrome revisited: an update on mechanisms and implications. Endocr Rev 2012 Dec; 33(6):981-1030.
- Conway G, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Franks S, Gambineri A, et al. The polycystic ovary syndrome: a position statement from the European Society of Endocrinology. Eur J Endocrinol 2014 Oct; 171(4):1-29.
- Escobar-Morreale HF, Carmina E, Dewailly D, Gambineri A, Kelestimur F, Moghetti P y cols. Epidemiology, diagnosis and management of hirsutism: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome Society. Hum Reprod Update 2012 Mar; 18(2):146-70.
- Dunaif A. Hyperandrogenic anovulation (PCOS): a unique disorder of insulin action associated with an increased risk of non-insulin-dependent diabetes mellitus. Am J Med 1995 Jan 16; 98(1A):33S-9S.
- Wu Y, Zhang J, Wen Y, Wang H, Zhang M, Cianflone K. Increased acylation-stimulating protein, C-reactive protein, and lipid levels in young women with polycystic ovary syndrome. Fertil Steril 2009 Jan; 91(1):213-9.
- Elci E, Kaya C, Cim N, Yildizhan R, Elci GG. Evaluation of cardiac risk marker levels in obese and non-obese patients with polycystic ovaries. Gynecol Endocrinol 2016 Jul 16; 1-5.
* Centro de Investigaciones Endocrinológicas “Dr. César Bergadá” (CEDIE)
CONICET – FEI – División de Endocrinología, Hospital de Niños Ricardo Gutiérrez.
Premio al mejor póster - XIX Congreso Internacional de Ginecología Infanto Juvenil - SAGIJ 2016

