Algoritmos diagnóstico-terapéuticos del SIL de alto grado en adolescentes
High-grade SIL: diagnostic-therapeutic algorithms in adolescents
Artículo de Revisión
Dra. Laura Fleider1, Dra. Agustina Puñal2, Dr. Silvio Tatti3
Resumen
Desde hace más de dos décadas se sabe que el 80% de las mujeres se infectarán por el virus del papiloma humano (VPH) durante su vida, algo más del 50% lo hace en los primeros 5 años de iniciadas sus relaciones sexuales. La edad de inicio de relaciones sexuales es aproximadamente a los 16,9 años de edad media. Esto convierte a las adolescentes en uno de los principales grupos de riesgo de contraer distintos tipos de infecciones de trasmisión sexual, entre ella VPH, cuya persistencia puede desencadenar lesiones que requieran tratamiento quirúrgico y comprometer la fertilidad de la mujer, y en algunos casos de continuar su historia natural sin ser detectadas gran parte de ellas pueden avanzar hacia el carcinoma invasor de cuello uterino.
Se recomienda iniciar el tamizaje del cáncer de cuello uterino entre los 21 y 25 años, salvo en pacientes con algún tipo de inmunocompromiso, en las cuáles se podría iniciar antes. La decisión de la edad de inicio del tamizaje se debe a la cronología de la historia natural de la infección por VPH.
El pico de incidencia de CIN 2 ocurre en mujeres menores de 25 años, en quienes la progresión a cáncer de cuello uterino (CCU) es muy lenta, por lo que hay un largo período de tiempo en el que se pueden detectar y tratar las lesiones cervicales precancerosas, siguiendo algoritmos diagnósticos preestablecidos.
Un caso sumamente complejo es el diagnostico de CIN2 en la adolescencia, nuestras recomendaciones para las pacientes adolescentes con CIN2, indican que la preferencia es la observación (siempre y cuando la paciente sea inmunocompetente, tenga posibilidades de seguimiento, no se encuentre dentro del grupo de pacientes de riesgos, ni haya tenido lesiones previas por HSIL en el TGI) y que el tratamiento podría ser aceptable. El seguimiento incluye la colposcopía y citología a intervalos de 6 meses. Si el CIN2 histológico persiste durante 2 años, se recomienda el tratamiento. La premisa fundamental es evitar el sobre tratamiento, y así evitar el riesgo aumentado de efectos adversos obstétricos.
Palabras clave: Virus del Papiloma Humano (VPH), cáncer de cuello uterino (CCU), adolescentes, HPV de alto riesgo, CIN 2, tamizaje.
Abstract
For more than two decades it has been known that 80% of women will be infected by the human papillomavirus (HPV) during their lives, slightly more than 50% do so in the first 5 years of having sexual intercourse. The age of onset of sexual intercourse is approximately 16.9y. Adolescents are one of the main risk groups for acquiring different types of sexually transmitted infections, including HPV, whose persistence can trigger lesions that require surgical treatment and compromise a woman's fertility, and in some cases that the lesions are not detected, they can continue their natural history and most of them can progress to invasive carcinoma of the cervix.
Cervical cancer screening is recommended to begin between the ages of 21 and 25, except in patients with some type of immunocompromise, in whom it could be started earlier. The decision of the age to start screening is due to the chronology of the natural history of HPV infection.
The peak incidence of CIN 2 occurs in women under 25 years of age, in whom progression to cervical cancer (CC) is very slow, so there is a long period of time in which precancerous cervical lesions can be detected and treated, following diagnostic algorithms presets.
An extremely complex case is the diagnosis of CIN2 in adolescence, our recommendations for adolescent patients with CIN2 indicate that the preference is observation (as long as the patient is immunocompetent, has follow-up possibilities, is not within the group of risk patients, or had previous HSIL lesions in the LGT) and that the treatment could be acceptable. Follow-up includes colposcopy and cytology at 6-month intervals. If histologic CIN2 persists for 2 years, treatment is recommended. The fundamental premise is to avoid overtreatment, and thus avoid the increased risk of adverse obstetric effects.
Key words: HPV, cervical cancer, adolescents, high risk HPV, CIN 2, cervical cancer screening
Introducción
El cáncer de cuello uterino (CCU) representa la cuarta enfermedad maligna más común que afecta a la mujer en todo el mundo y es la segunda en los países en desarrollo. En estas áreas, la carga de la enfermedad sigue siendo importante debido a la dificultad en la ejecución de los programas de tamizaje basados en la citología.
Los principales obstáculos inherentes a estos países son la pobreza que se acompaña por falta de infraestructuras sanitarias, bajo nivel de educación y dificultades para concurrir a centros de atención médica.
En la Región de las Américas, en el año 2018 más de 72.000 mujeres fueron diagnosticadas de CCU y casi 34.000 fallecieron por esta enfermedad. Las tasas de mortalidad son 3 veces más altas en América Latina y el Caribe que en Norteamérica, evidenciando enormes desigualdades en salud1.
En Argentina, cada año se diagnostican alrededor de 4.000 casos nuevos de cáncer de cuello de útero y mueren cerca de 2000 mujeres a causa de la enfermedad. El 82% de las muertes ocurre en mujeres mayores de 40 años2.
Con la disponibilidad de nuevas tecnologías, en el mundo se han tratado de encontrar nuevas estrategias que se adapten a países de bajos y medianos ingresos para promover el diagnóstico precoz del CCU.
La evidencia actual sugiere que las pruebas de detección del Virus del Papiloma Humano (VPH) son más eficaces que la citología para la detección del CCU. Por lo tanto, pruebas altamente sensibles han sido desarrolladas para el tamizaje primario.
Métodos moleculares para la detección de ADN del VPH están actualmente disponibles en el mercado. Esto constituye un hito en la detección del cáncer cervical en entornos de bajos recursos, ya que puede ayudar a superar la gran mayoría de los obstáculos inherentes a los programas de tamizaje anteriores.
A pesar de varias ventajas, el tamizaje basado en la detección del VPH tiene un bajo valor predictivo positivo para el CCU y las lesiones preinvasoras, de modo que las mujeres VPH positivas necesitan ser sometidas a un triage para determinar el manejo óptimo, como pruebas de inspección visual, citología y nuevos biomarcadores entre algunas opciones3.
La persistencia viral es un paso decisivo en la transformación maligna; al permitir la integración del VPH y sobreexpresión de las oncoproteínas E6 y E7, capaces de interferir con el normal funcionamiento de las proteínas p53 y pRB de la célula huésped.
Desde un punto de vista clínico, la persistencia del VPH en las células del epitelio cervical resulta en el desarrollo de lesiones intraepiteliales del cuello uterino, que ocurren con mayor frecuencia en mujeres jóvenes, con una edad promedio de 20 a 30 años. Un alto porcentaje de ellas desarrollará lesiones intraepiteliales de alto grado, debiendo ser tratadas mediante técnicas quirúrgicas para evitar su transformación maligna.
La incorporación de métodos de diagnóstico cito-histológicos y el aporte de otros métodos diagnósticos moleculares al tamizaje del cáncer cervical, permiten en la actualidad la detección de lesiones precursoras, facilitando la aplicación de un tratamiento precoz y reduciendo, por lo tanto, el impacto.
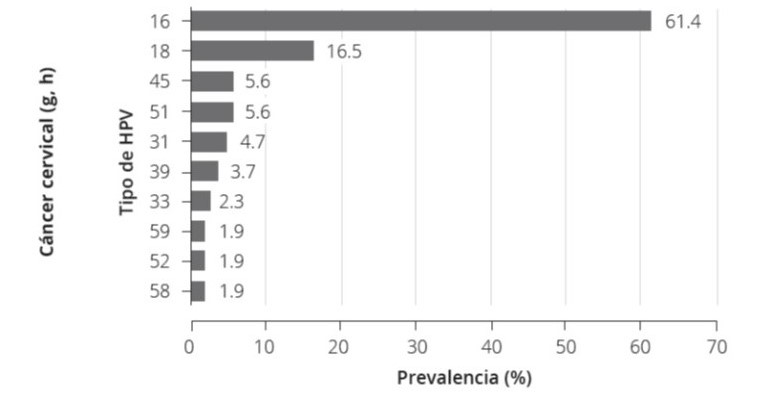
Desde hace más de 2 décadas se sabe que el 80% de las mujeres se infectan por VPH durante su vida, algo más del 50% lo hace en los primeros 5 años de iniciadas sus relaciones sexuales; siendo la duración media de la infección de 12 meses aproximadamente, pudiendo ser de mayor tiempo cuando los tipos involucrados son VPH 16 y 184. Las mujeres infectadas que presentan persistencia viral constituyen un grupo de riesgo para desarrollar cáncer cervical5. Los tipos de VPH con mayor índice de persistencia y por ende más frecuentes en el cáncer cervical son los 16, 18, 45, 31, 33, 52, 58 y 35. Los tipos 16, 18, 31, 33 y 45; son la causa de aproximadamente el 95% de los cánceres de cuello uterino6.
En Argentina, para el año 2019; los tipos de VPH 16 y 18 se encuentran en el 61,4% y 16,5% respectivamente; seguidos en orden de frecuencia por los tipos 45, 51, 31, 39, 33, 59, 52 y 587 (Fig. 1)
Figura 1. Tipos de VPH en el CCU en Argentina7
Actualmente se puede detectar la infección por VPH mediante técnicas moleculares que detectan ADN o ARN viral, por lo que desde hace varios años se comenzó a proponer su implementación en el tamizaje. La mayoría de los métodos moleculares disponibles para el diagnóstico de infección viral por VPH se basan en el análisis de ADN (detección del ADN del genoma viral), el cual permite demostrar la presencia del virus; pero poco dice acerca de su integración. Estos métodos que detectan ADN son mucho más sensibles, pero menos específicos que la citología en la detección de lesiones intraepiteliales de alto grado (HSIL) y del cáncer cervical, tanto escamoso como glandular8.
Entre las pruebas moleculares que se disponen actualmente para la detección de ADN del VPH, las más utilizadas son PCR (Reacción en Cadena de la Polimerasa) y Captura de Híbridos tipo 2; con muy buena sensibilidad, pero muy baja especificidad; debido a que detectan infecciones que tienen alta posibilidad de regresión, por lo cual carecerían de significado clínico.
Otras pruebas detectan ARN mensajero (ARNm) de las oncoproteínas E6/E7, estas técnicas tienen mayor especificidad que las que detectan ADN, ya que estas proteínas sólo se expresan una vez que el VPH se ha integrado al genoma de la célula huésped, pero menor sensibilidad, ya que detectan el ARNm de unos pocos tipos de VPH9-10-11.
En nuestro país, el Ministerio de Salud de la Nación ha aprobado la incorporación del test de VPH como método de tamizaje para la prevención del CCU a partir de los 30 años. En el año 2011, el Programa Nacional de Prevención de Cáncer Cervicouterino (PNPCC) -dependiente del Instituto Nacional del Cáncer (INC) - comenzó la introducción del test de VPH mediante un proyecto de demostración en la provincia de Jujuy. Luego de tres años de implementación del proyecto, quedó demostrado que esta nueva tecnología duplica la capacidad de detección de lesiones precancerosas y cáncer.
A partir de estos buenos resultados obtenidos en la provincia de Jujuy, en los años 2014 y 2015 se incorporaron cinco nuevas provincias al tamizaje basado en el test de VPH (Catamarca, Neuquén, Misiones, Tucumán, y tres partidos de la Provincia de Buenos Aires). Y en los años subsiguientes dicho test se ha ido incorporando a los programas de tamizaje de otras provincias y del Gran Buenos Aires. A partir de la incorporación del test de VPH como estrategia de tamizaje en la provincia de Jujuy, en el año 2011 el PNPCC elaboró una primera versión de las recomendaciones con el objetivo de establecer los criterios de acción para el tamizaje, seguimiento y tratamiento de mujeres para la prevención del CCU en contextos de tamizaje con test de VPH. En el año 2015, a partir de la incorporación de nuevas provincias al tamizaje con dicha estrategia y de la introducción de la autotoma al tamizaje programático, se evaluó la necesidad de actualizar el documento. Para ello, se revisó la nueva evidencia científica acerca del tamizaje con test de VPH en ambas modalidades (toma convencional y autotoma), y se analizaron las guías programáticas.
Asimismo, durante los años 2012 y 2013 el Ministerio de Salud de la Nación, en conjunto con el Ministerio de Salud de la provincia de Jujuy y la Agencia Internacional para la Investigación del Cáncer (IARC), llevó adelante el Proyecto EMA, un estudio randomizado cuyo objetivo principal ha sido evaluar la efectividad de la autotoma para el aumento de la cobertura y su efectividad para la detección de lesiones CIN2+. Los resultados de dicho estudio mostraron que con la autotoma se logró aumentar cuatro veces la cantidad de mujeres tamizadas, y la tasa de detección de lesiones CIN2+ fue superior a la obtenida con la Prueba de Papanicolaou durante el 2011. A partir de los resultados obtenidos en este estudio, las provincias de Jujuy y Tucumán incorporaron la autotoma al tamizaje programático en los años 2014 y 2015 respectivamente12.
Historia natural de la infección por VPH
Al iniciar su actividad sexual, la mujer puede ser contagiada por VPH de alto riesgo, que en la gran mayoría de los casos dará lugar a una infección transitoria, haciéndose indetectable en 6-12 meses4. Cualquier variable ligada a la actividad sexual, incluyendo la edad joven, el número de parejas sexuales, parejas sexuales recientes, y tener relaciones sexuales con parejas que tienen otras parejas sexuales, incluyendo tanto a hombres y mujeres, es un factor de riesgo para la infección genital por el VPH.
La historia natural de una enfermedad pasa por cuatro etapas sucesivas:
- Comienzo biológico. No la detectamos, pero está presente.
- Diagnóstico precoz posible (DPP). No hay síntomas, pero si hay cambios estructurales o funcionales que se pueden poner de manifiesto con las pruebas apropiadas.
- Diagnóstico clínico usual (DCU). Aparecen los síntomas, el individuo enferma y solicita ayuda.
- Resultado. La enfermedad llega a su “resultado”: recuperación, incapacidad o muerte.
Hutchinson describió hace más de 40 años el Concepto de punto crítico y sería aquel punto de la evolución de la enfermedad antes del cual, el tratamiento es más efectivo o fácil de aplicar que más tarde.
Los estudios retrospectivos demuestran que la infección cervical persistente por VPH de alto riesgo precede a la aparición de las lesiones intraepiteliales cervicales y es necesaria para el desarrollo, mantenimiento y progresión de estas lesiones.
Una microabrasión del epitelio es necesaria para que el VPH infecte las células basales del epitelio estratificado genital, especialmente en la Zona de Transformación. Los estudios de prevalencia e incidencia de infecciones detectadas durante seguimientos longitudinales de las mujeres jóvenes muestran que la mayoría de las infecciones por VPH cervical son benignas y se resuelven espontáneamente, sin la necesidad de la intervención médica13.
Ocasionalmente, esta infección desarrollará una lesión intraepitelial diagnosticada por citología o histología las cuales se resuelven espontáneamente en la mayoría de los casos. Cuando el virus no es eliminado y persiste la infección por VPH de alto riesgo, la lesión precursora se mantiene y tiene altas posibilidades de progresar a cáncer invasor14. En la Fig. 2 podemos ver la progresión de la infección por VPH al CCU.
Figura 2. Progresión al cáncer mediada por el VPH15
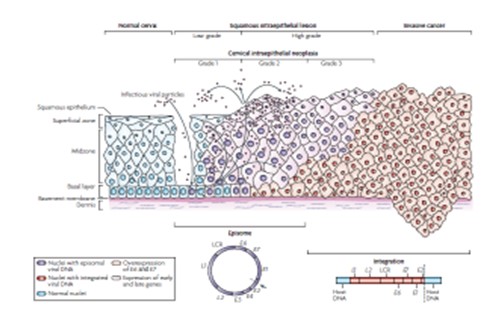
El paso previo a la invasión sería el carcinoma in situ de cuello uterino, conocido como CIN 3, que ocurre en mujeres jóvenes con una edad media de 28 años. En estos casos, la necesidad de realizar tratamientos escisionales para prevenir el cáncer expone a estas jóvenes mujeres a tener como consecuencia alteraciones de la fertilidad.
A diferencia de los VPH de bajo riesgo, los cuales permanecen en el núcleo de la célula infectada en situación episómica, los VPH de alto riesgo ejercen su actividad oncogénica, aunque no exclusivamente, tras integrarse en el genoma celular. El mecanismo mejor conocido de inducción neoplásica por VPH se produciría a partir de la síntesis de las proteínas virales E6 y E7. Estas proteínas se ligan a las proteínas producidas por los genes supresores de tumores p53 y pRb respectivamente, alterando su función. Esta interacción en células proliferativas, como son las del cuello uterino y especialmente de la zona de unión escamo-cilíndrica con un epitelio inestable, impide la correcta reparación del ADN, conduce a una inestabilidad genómica y aumenta la probabilidad de desarrollar mutaciones específicas, esenciales para la progresión a cáncer invasor16.
Varios cofactores se han asociado a la persistencia de la infección por VPH en el cuello de útero, todos ellos han sido estudiados y su asociación con la persistencia viral ha sido establecida, entre ellos citamos el tabaquismo, los anticonceptivos orales a largo plazo, la multiparidad, infección por VIH e inmunocompromiso entre otros17-18-19-20-21-22, pero el genotipo del VPH sigue siendo el mejor predictor de riesgo para la progresión de la enfermedad.
Jacobs y Walboomers23 en un trabajo sobre 3305 extendidos normales, detectaron un pico de prevalencia para todos los tipos de VPH de 19,6 % en mujeres de 25 a 29 años, que disminuyó a 4,3 % en mujeres mayores de 30 años. Las mujeres mayores tienen un riesgo menor de adquirir infecciones nuevas por VPH que las más jóvenes. La alta incidencia y la corta duración, son las características representativas de la infección por VPH en la mujer joven. Mujeres con extendidos de Papanicolaou normales y ADN de VPH de alto riesgo, tenían un riesgo 116 veces mayor de desarrollar una lesión intraepitelial de alto grado24.
Una alta carga viral de VPH de alto riesgo oncogénico en un primer examen está significativamente asociada con la persistencia de la infección y con la aparición de lesiones de alto grado durante su seguimiento8. Nobbenhuis y col25, en el seguimiento de 353 pacientes con diagnóstico de discariosis moderada a severa, detectaron que las 33 pacientes que presentaron progresión clínica también presentaban infección persistente por VPH de alto riesgo, mientras que no se detectó progresión en las pacientes que tenían test negativo para VPH.
No es posible monitorizar la latencia de una infección a través de marcadores inmunológicos específicos, ya que una proporción significativa de las mujeres infectadas por el VPH no desarrollan anticuerpos detectables VPH específicos. No se entiende bien el motivo por el cual algunas mujeres desarrollan anticuerpos y otras no. Desde una perspectiva práctica, esta observación hace que sea poco probable que un simple examen de sangre para detectar infección por VPH esté alguna vez disponible. El VPH tiene mecanismos de evasión inmune, que hacen factible su persistencia a través de los años, integración y desarrollo de cáncer.
La utilidad de las pruebas de detección viene dada por la ubicación del punto crítico en la Historia Natural de la enfermedad. Sólo cuando el punto crítico se encuentre entre el diagnóstico precoz posible (DPP) y el diagnóstico clínico usual (DCU), la enfermedad es vulnerable a la detección oportuna26-27-28-29. El cáncer de cuello cumple con estos requisitos para el diagnóstico precoz.
Prevención secundaria del cáncer de cuello uterino
El objetivo de la prevención secundaria mediante el tamizaje es la detección de las lesiones intraepiteliales de alto grado (CIN 2-3), cáncer micro-invasor y adenocarcinoma in situ, para poder realizar un tratamiento temprano y disminuir la incidencia y mortalidad por cáncer cervical.
Una técnica de tamizaje no es una técnica diagnóstica y debe cumplir los siguientes criterios: ser simple, aceptable, no dolorosa, segura, validada y económica. Hay varios pre-requisitos para que un programa de tamizaje sea exitoso. Los más conocidos fueron publicados por Wilson y Jungner en 1968, y son válidos actualmente30. Estos criterios incluyen:
- La condición buscada debería ser un importante problema de salud
- Debería existir un tratamiento aceptable para las pacientes con esa enfermedad
- El diagnóstico y tratamiento deberían ser accesibles
- Debería tener un estado latente o de síntomas tempranos
- Debería tener un test o examen apropiado
- El test debe ser aceptado por la población
- La historia natural de la enfermedad debería ser comprendida adecuadamente
- Debería haber un acuerdo sobre quienes considerar como pacientes
- El costo debería ser económico, incluyendo los gastos del cuidado médico
- El hallazgo de casos debería ser un proceso continuo, y no una sola vez para todo el proyecto
El tamizaje se puede realizar desde dos estrategias distintas. Una es la llamada de catastro: aquí se realizan pruebas a personas del público general con el objeto de identificar aquellas que tienen más chance de padecer determinada enfermedad y luego de identificada se la estudia definitivamente (tamizaje de masas o mass screening). La segunda estrategia se basa en que el médico es visitado con frecuencia y esta es una buena oportunidad para realizarle un test independiente del motivo de consulta. A esta estrategia se la conoce como búsqueda de casos (case finding).
Por último, debemos decir que el tamizaje en realidad no hace el diagnóstico, sino que selecciona una población a la que se le realizarán otras pruebas más específicas para confirmar la sospecha (triage). Esta sutil diferencia es la que hay entre tamizaje y diagnóstico precoz31.
Analicemos ahora cómo seleccionar un test o prueba que detecte la enfermedad en su periodo asintomático.
La evaluación de una prueba de detección no difiere de la de cualquier otra prueba diagnóstica. La confiabilidad de la prueba vendrá dada por la precisión y exactitud así como por la reproducibilidad, validez y valor de predicción. De estos parámetros cobran mayor jerarquía la validez que estará compuesta por la sensibilidad, la especificidad y el valor predictivo.
La sensibilidad de una prueba reside en su capacidad para detectar la presencia de un cáncer existente o lesión precancerosa y se define como la proporción de personas afectadas con resultado de la prueba positivo.
La especificidad es la exactitud con que una prueba demuestra la ausencia de un cáncer o lesión precursora inexistente y se define como la proporción de personas no afectadas con resultado de la prueba negativo.
Una prueba de baja sensibilidad producirá falsa tranquilidad y pérdida de recursos en la detección. Una prueba de baja especificidad provocará falsos positivos y por lo tanto alarma innecesaria, ansiedad y pérdida de recursos en investigaciones ulteriores además de posible iatrogenia.
Con respecto a la sensibilidad deberemos tener en cuenta además que en general no contamos con el número de personas con prueba negativa que realmente no tienen la afección ya que estas personas no se estudian ulteriormente. Por lo tanto se dispone de más información acerca del valor predictivo positivo de una prueba. Este valor es la probabilidad de que un resultado positivo sea confirmado en estudios posteriores y se define como la proporción de personas con resultado positivo y que realmente están afectadas.
Algoritmos diagnóstico-terapéuticos del SIL de alto grado en la adolescencia
Definimos adolescencia a la etapa comprendida luego de la infancia y que abarca desde la pubertad hasta el completo desarrollo del organismo. Se trata de un cambio de cuerpo y mente pero que no solo acontece en el propio adolescente, sino que también se conjuga con su entorno. La adolescencia varía su duración en cada persona.
De acuerdo con la OMS la sexualidad abarca al sexo, las identidades, el género, el erotismo, el placer, la intimidad, la reproducción y la orientación sexual. En esta etapa cobra gran relevancia lo que los coloca a los adolescentes en una situación de vulnerabilidad.
En las últimas décadas se ha podido observar el descenso de edad en el inicio de las relaciones sexuales. El estudio Afrodita publicado en el año 2009 revela que dicha edad de inicio de actividad sexual ha bajado casi seis años respecto al de las mujeres entre 56 y 65 años, situándose ahora en los 16,9 años de media32. A su vez el inicio precoz en las relaciones sexuales se acompaña de un aumento en el número de infecciones de transmisión sexual, entre ellas HPV, Chamydia, sífilis, entre otras; potenciando la vulnerabilidad.
Según los algoritmos de tamizaje que hemos elaborado en el Hospital de Clínicas “José de San Martín” de la Universidad de Buenos Aires para el año 2020, recomendamos iniciar el tamizaje del CCU entre los 21 y 25 años, salvo en pacientes con algún tipo de inmunocompromiso, terapia con corticoides o algún otro factor de inmunodepresión, en las cuáles se podría iniciar antes. La decisión de la edad de inicio del tamizaje, se debe a la cronología de la historia natural del cáncer de cuello uterino, ya que hoy sabemos que la edad media de detección de lesiones CIN 3 es a los 29 años, así como a la baja carga de morbilidades que presentan las pacientes a corta edad. La baja tasa de mortalidad por CCU en menores de 25 años, según estadísticas argentinas, que coinciden con las estadísticas globales, avala esta decisión.
Aclaramos que el método elegido es la citología, ya que las pruebas moleculares detectan un número elevado de infecciones transitorias que curan espontáneamente y llevarían a sobre tratamientos.
También es importante remarcar el riesgo aumentado de efectos adversos obstétricos que se relacionan con lesiones precursoras tratadas en exceso. La premisa fundamental es evitar el sobre tratamiento, como se verá más adelante.
Múltiples estudios han demostrado que la población adolescente es uno de los grupos etarios con tasas más altas de infección por VPH. Un porcentaje muy alto de ellos adquirirán la infección dos o tres años después del inicio de sus relaciones sexuales. El pico de infección se produce por debajo de los 25 años para luego ir disminuyendo.
La vulnerabilidad de estas pacientes tiene que ver por un lado con sus hábitos sexuales, pero, por el otro, el cuello uterino de las adolescentes tiene grandes áreas de epitelio inmaduro y predominancia de epitelio columnar y metaplásico expuesto hacia la vagina. La unión entre el epitelio glandular y el escamoso se localiza en la etapa neonatal en el orificio cervical externo y permanecerá allí hasta la pubertad, momento en el cual como consecuencia de los cambios hormonales se producirá una transformación de las células glandulares en escamosas, proceso denominado “metaplasia escamosa”. La consecuencia es el desplazamiento de la unión escamo cilíndrica y la adquisición de una zona de transformación, siendo ésta el sitio más vulnerable para las lesiones producidas por la infección por VPH.
Las resecciones utilizadas para el tratamiento de las lesiones intraepiteliales de alto grado tienen consecuencias adversas en el futuro reproductivo, incluidos el incremento de la tasa de cesáreas, los partos prematuros y la morbilidad neonatal, especialmente cuando la resección es mayor a 1.5cm de profundidad. Un estudio publicado en el año 201233 de un total de 353 pacientes sometidas a un tratamiento LLETZ (del inglés: Large Loop Escision of the Transformation Zone – Escision Grande con Asa de la Zona de Transformación) y que posteriormente tuvieron un embarazo, se incluyeron en el estudio a 321 elegibles. De este total de pacientes, un 76.3% resultaron en un embarazo a término, el 9.1% tuvo un parto menor a 37 semanas de gestación y el 14.6% un aborto espontáneo antes de la semana 24 de gestación. Por otro lado se vio un incremento de tres veces en el riesgo de trabajo de parto pre término si el volumen de la escisión superaba los 6 cm (RR = 3,00; IC del 95%: 1,45-5,92) o cuando el grosor del tejido extirpado era superior a los 12 mm. Por el contrario, el intervalo de tiempo entre el tratamiento LLETZ y el embarazo no pareció tener efecto sobre estas tasas.
También los tratamientos destructivos como crioterapia, vaporización y electrocoagulación pueden tener consecuencias adversas en este sentido. Así, en caso de realizarse el tamizaje en mujeres de este grupo etario, el manejo de las alteraciones cito e histológicas debe adaptarse a la historia natural de la infección por VPH y tener como premisa fundamental la de evitar el sobretratamiento.
El CIN1 es un diagnóstico histológico asociado con la replicación viral benigna y en la mayoría de los casos regresa espontáneamente. Los estudios en mujeres adultas muestran tasas de regresión de 70 a 80%, mientras que, en adolescentes y mujeres jóvenes, más del 90% muestran regresión. Debido a estas altas tasas de regresión, recomendamos manejar de manera conservadora con observación, en lugar de tratar el CIN1 en adolescentes.
Por el contrario, el CIN3 se considera un verdadero pre cáncer con el potencial de progresar a un cáncer invasivo a una tasa del 0,2% al 4% en 12 meses y siempre debe ser tratado por métodos escisionales, independientemente de la edad de la mujer.
El comportamiento biológico de CIN2 es más controvertido. Desde un punto de vista morfológico se define como lesiones que comprometen dos capas del epitelio escamoso. Esto genera un desafío diagnóstico ya que se pueden presentar dificultades para diagnosticar lesiones que comprometen una o dos capas del epitelio. En el estudio ALTS publicado en el año 2007 de 545 mujeres con diagnóstico histológico de CIN 2, se vio que la concordancia inter observador fue del 43%34; y desde un punto de vista biológico se las puede incluir dentro de las lesiones intraepiteliales de alto grado, cuando se encuentran indicios moleculares de alterar las mitosis de la célula huésped, indicando fenómenos de progresión al cáncer.
El pico de incidencia de CIN 2 ocurre en mujeres menores de 25 años, a su vez la progresión a CCU es muy lenta, por lo que hay un largo período de tiempo en el que se pueden detectar y tratar las lesiones cervicales precancerosas. Ciertamente, las tasas de cáncer de cuello uterino son bajas en adolescentes y mujeres jóvenes, lo que respalda que la progresión de CIN2 a cáncer en este grupo de edad es extremadamente rara, siendo muy alta la regresión espontánea de estas lesiones.
Al igual que con CIN1, los datos en adolescentes sugieren que CIN2 tiene una probabilidad mucho mayor de regresión. En un análisis del que participaron 95 mujeres entre 13 y 24 años, remitidas con diagnóstico histológico de CIN2, el 38% se eliminó en el primer año, el 63% en el segundo año y el 68% en el tercer año. El 15% de las mujeres mostró progresión en el tercer año35. Como conclusión se puede arribar que la alta tasa de regresión de CIN2 en adolescentes respalda la observación clínica de estas lesiones.
Sabemos que entre los riesgos de realizar amplias resecciones innecesarias con LLETZ en pacientes con CIN 2 figuran el parto pretérmino, el bajo peso al nacer y ruptura prematura de membranas.
Por todo lo expuesto anteriormente es importante preguntarnos si es realmente necesario realizar tratamiento del CIN 2 en todas las pacientes menores de 25 años. El manejo conservador está relacionado a que el 20% de las mujeres que se trataron inmediatamente luego de ser diagnosticadas tuvieron histología normal o con lesiones de bajo grado histológico en la biopsia de la pieza escisional36.
Nuestras recomendaciones para las pacientes adolescentes con CIN2, en coincidencia con las recomendaciones de la Sociedad Americana de Colposcopia y Patología Cervical (ASCCP) para el año 2020 indican que la preferencia es la observación y el tratamiento podría ser aceptable. El seguimiento incluye la colposcopía y citología a intervalos de 6 meses. Si el CIN2 histológico persiste durante 2 años, se recomienda el tratamiento. Enfatizamos que ante un diagnóstico histológico de CIN 3 histológico debe tratarse siempre.
Bibliografía
- Cáncer Cérvicouterino https://www.paho.org/hq/index.php?option=com_content&view=article&id=5420:2018-cervical-cancer&Itemid=3637&lang=es accesado 10/05/20
- Guía Programática Abreviada para el tamizaje del Cáncer Cérvicouterino - Programa Nacional de Prevención de Cáncer Cervicouterino http://www.msal.gob.ar/images/stories/bes/graficos/0000000433cnt-Guia_Programatica_Abreviada_BAJA.pdf accesado el 14/6/20
- Catarino R, Petignat P, Dongui G, Vassilakos P. Cervical cancer screening in developing countries at a crossroad: Emerging technologies and policy choice World J Clin Oncol. 2015; 10; 6(6): 281–290.
- Ho GY, Bierman R., Beardsley L, Chee J. Chang J., Burk R. Natural History of Cervicovaginal Papillomavirus Infection in Young Women N Engl J Med 1998; 388: 423-42
- Schiffman M, Castle PE Human Papillomavirus Epidemiology and Public Health Arch Pathol Lab Med 2003; 127: 930-934
- Bosch FX, Lorincz A., Muñoz M., Meijer C., Shah k. The causal relation between Human Papillomavirus and Cervical Cancer J Clin Pathol 2002; 55: 244-265
- Human Papillomavirus and Related Diseases Reports Argentina junio 2019 https://hpvcentre.net/statistics/reports/ARG.pdf?t=1570460788215 accesado 10/05/20
- Clavel C, Masure M, Bory JP, Putaud I, Mangeonjean C, Lorenzato M, Gabriel R, Quereux C., Birembaut P. Hybrid capture II-*based human papillomavirus detection, a sensitive test to detect in rutine high-grade cervical lesions: a preliminary study on 1518 women. Br J Cancer 1999; 80 (9): 1306-1310
- Sotlar K, Stubner A, Diemer D., Menton S., Menton M., Dietz K., Wallwiener D., Kandolf R., Bültmann B. Detection of high‐risk human papillomavirus E6 and E7 oncogene transcripts in cervical scrapes by nested RT‐polymerase chain reaction. J Med Virol 2004; 74(1): 107‐116
- Cuzick J. Human Papillomavirus testing for primary cervical cancer screening JAMA 2000; 283 (1):108-109
- Lie AK, Risberg B, Borgea B., Sandstadbc B., Delabiea J., Rimalad R., Onsrude M., Thoresenf S. DNA‐versus RNA‐based methods for human papillomavirus detection in cervical neoplasia. Oncol 2005; 97(3): 908‐915
- Recomendaciones para el tamizaje, seguimiento y tratamiento de mujeres en el marco de programas de tamizaje basados en el test de VPH ACTUALIZACIÓN 2015 http://www.msal.gob.ar/images/stories/bes/graficos/0000000017cnt-manual_recomendaciones_tamizaje_2015_baja.pdf accesado el 29/5/20
- Winer RL, Hughes JP, Feng Q, Xi L, Cherne S, O'Reilly S, Kiviat N., Koutsky L. Early natural history of incident, type-specific human papillomavirus infections in newly sexually active young women. Cancer Epidemiol Biomarkers Prev 2011;20 (4): 699–707.
- Schiffman M, Castle PE. The promise of global cervical cancer prevention. N Engl J Med 2005; 353: 2101-2104.
- Woodman C., Collins S., Young L. The natural history of cervical HPV infection: unresolved issues Nature Reviews Cancer 2007; 7: 11-22.
- Alazawi W, Pett M., Arch B., Scott L., Freeman T., Stanley M., Coleman N. Changes in cervical keratinocyte gene expression associated with integration of human papillomavirus 16. Cancer Res 2002; 62: 6959-6965
- Castellsague X, Munoz N. Chapter 3: Cofactors in human papillomavirus carcinogenesis-role of parity, oral contraceptives, and tobacco smoking. J Natl Cancer Inst Monogr 2003; 20–28.
- Plummer M, Herrero R, y col. Smoking and cervical cancer: pooled analysis of the IARC multi-centric case-control study. Cancer Causes Control 2003;14:805–14
- Moreno V, Bosch X., Muñoz N., Meijer C., Shah K., Walboomers J., Herrero R., Franceschi s. for the International Agency for Research on Cancer (IARC) Multicentric Cervical Cancer Study Group. Effect of oral contraceptives on risk of cervical cancer in women with human papillomavirus infection: the IARC multicentric case-control study. Lancet 2002; 359:1085–92
- Muñoz N, Franceschi S., Bosetti C., Moreno V., Herrero R., Smith J., Shah K., Meijer C., Bosch X., for the International Agency for Research on Cancer (IARC) Multicentric Cervical Cancer Study Group Role of parity and human papillomavirus in cervical cancer: The IARC multicentric case-control study. Lancet 2002;359:1093–101.
- Vermund S., Kelley K. Impact of HIV on human papilloma virus-mediated cervical disease progression AIDS 2018, 32:1715–1717
- Reinholdt K., Thomsen L., Dehlendorff C., Larsen H., Sørensen S., Hædersdal M., Kjær S. Human papillomavirus (HPV)-related anogenital premalignancies and cancer in renal transplant recipients: a Danish nationwide, registry-based cohort study. Int J Ca 2020; 146 (9): 2413-2422
- Jacobs M, Walboomers J., Snijders P., Voorhorst F., Verjeijen R., Fransen-Daalmeijer N., Meijer C. Distribution of 37 mucosotropic HPV types in women cytologically normal cervical smears: the age-related patterns for high-risk and low-risk types. Int J Cancer 2000; 87: 221-227
- Rozendaal L, Walboomers J., van der Linden J., Voorhorst F., Kenemans P., Helmerhost T., van Ballegooijen M., Meijer C. PCR-based high-risk HPV test in cervical cancer screening gives objective risk assessment of women with cytomorphologically normal cervical smears Int J Cancer 1996; 68 (6): 766-9
- Nobbenhuis M, Walboomers J., Helmerhorst T., Rozendaal L., Remmink A., Risse E., van der Linden H., Voorhorst F., Kenemans P., Meijer C. Relation of human papillomavirus status to cervical lesions and consequences for cervical cancer screening: a prospective study. Lancet 1999; 354: 20-25
- Nielsen C., Lang R. Principles of screening. Med Clin North Am. 1999; 83(6): 1323-1337.
- Fink D, Mettlin C. Detección del cáncer: pautas para la revisión periódica en busca de cáncer. In: Murphy GP, Lawrence W, Lenhard RE. Oncología Clínica. Manual de la American Cancer Society. Washington, D.C.. O.P.S., 2ª ed. 1996: 202-219
- MacLean C. Principios de la detección de cáncer. Clínicas Médicas de Norteamérica. 1996; 1: 1-13
- Sackett D, Haynes R, Guyatt G, Tugwell P. Diagnóstico precoz. In: Epidemiología clínica. Ciencia básica para la medicina clínica. Buenos Aires: Panamericana, 2ªed. 1994: 158-175
- Wilson J, Jungner G. Principles and practice of screening for disease. World health Organization Public Health Paper 34, WHO, Geneva 1968
- Cabello Lopez J. El consejo médico: la prevención primaria y secundaria de la enfermedad, principios del screening. Medicine 1998; 7(104): 4866-4871.
- Puig-Tintoré L, Bosch X, Castellsagué X, Cortés J, Roura E, de Sanjosé S, et al. Estudio Afrodita: cribado del cáncer de cuello uterino en España y factores relacionados : análisis de la conducta sexual, de la historia reproductiva y del conocimiento causal del cáncer de cérvix y su prevención entre las mujeres españolas: GlaxoSmithKline; 2009
- Khalid S., Dimitriou E y col The thickness and volume of LLETZ specimens can predict the relative risk of pregnancy-related morbidity BJOG 2012; 119(6): 685-691
- Castle y col ASCUS/LSIL Triage Study Am J Clin Pathol 2007; 127: 805-815
- Mosicki AB, Ma Y y col Rate of and risks for regression of cervical intraepithelial neoplasia 2 in adolescents and young women Obstet Gynecol 2010; 116 (6): 1373-1380
- Mc Allum B., Sykes P y col Is the treatment of CIN 2 always necessary in women under 25 years old? Am J Obstet Gynecol 2011; 205 (5): 478.e1-7.
¹ Doc. Aut. Ginecología UBA, Jefa Sección Patología Cervical del Hospital de Clínicas “José de San Martín” UBA, Subdirectora de la Carrera de Médico Especialista en Patologías del Tracto Genital Inferior de la Universidad de Buenos Aires
² Médica ginecóloga del Programa de Prevención, Diagnóstico, Terapéutica y Vacunación en el TGI. División Ginecología Hospital de Clínicas “José de San Martín” UBA
³ Prof. Titular de Ginecología UBA, Director del Programa de Prevención, Diagnóstico, Terapéutica y Vacunación en Patologías del TGI del Hospital de Clínicas “José de San Martín” UBA, Director de la Carrera de Médico Especialista en Patologías del Tracto Genital Inferior de la Universidad de Buenos Aires
División Ginecología Hospital de Clínicas “José de San Martín” UBA
Córdoba 2351, C1028 CABA Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.

