Teratoma Inmaduro de ovario en la población adolescente: revisión a partir de un caso clínico.
Immature Ovarian Teratoma in the Adolescent Population: A Review based on a clinical case.
Artículo de Revisión
Dres.: Lucila Othatz1, María Edurne Ormaechea2, Alejandra Wernicke3, Patricia Streitenberger4, Mariela Orti5, María Laura Cesarato6.
Resumen
La mayoría de los blastomas anexiales en las niñas y adolescentes son benignos, y sólo un 10-20% son malignos. Los teratomas de ovario pueden ser maduros e inmaduros. El teratoma inmaduro de ovario es infrecuente, con una incidencia de 2,2 en 100.000 niñas entre 0-15 años.
En la población pediátrica y en pre menárquicas son una patología muy poco frecuente. Su abordaje puede ser un desafío para el ginecólogo especialista en ginecología infantojuvenil, y el manejo debe ser interdisciplinario. La cirugía es el tratamiento de elección en los estadios iniciales.
El buen pronóstico en los estadios iniciales de aquellos de bajo grado, hace pertinente priorizar la preservación de la fertilidad y realizar seguimiento estricto.
El objetivo de este artículo es realizar una revisión bibliográfica a partir de un caso clínico del manejo de los teratomas inmaduros de ovario. Se realizó una búsqueda bibliográfica en PubMed y el criterio de inclusión utilizado fue la terminología “teratoma inmaduro de ovario en población pediátrica y adolescente”.
Palabras clave: blastoma anexial, premenárquica, teratoma, teratoma inmaduro, pediátrica.
Abstract
Most adnexal blastomas in girls and adolescents are benign, with only 10-20% being malignant. Ovarian teratomas can be mature or immature. Immature ovarian teratoma is uncommon, with an incidence of 2.2 in 100,000 girls between 0-15 years. In the pediatric and pre-menarchal population, they are a very rare pathology, presenting a challenge for gynecologists specializing in pediatric and adolescent gynecology.
Their management and approach should be interdisciplinary, with surgery being the treatment of choice in the early stages. The favorable prognosis in the early stages, especially for those of low grade, emphasizes the importance of prioritizing fertility preservation and strict follow-up.
The objective of this article is to conduct a literature review based on a clinical case regarding the management of immature ovarian teratomas. A literature search was conducted on PubMed, with the inclusion criterion being the terminology 'immature teratoma on pediatric and adolescent population'.
Keywords: adnexal blastoma, premenarchal, teratoma, immature teratoma, pediatric.
Introducción
La mayoría de las masas anexiales que se presentan en la población pediátrica son benignas. Con una incidencia anual de 2.6 por cada 100.000 niñas.1,2,3 Dentro de los tumores de ovario en este rango etario, solo el 1% son malignos4,5,6,7 y de todos aquellos con indicación quirúrgica, un 10-20% son malignos4. Generalmente la sobrevida global es alta. (8) De los tumores de ovario, la estirpe histológica que más frecuentemente se presenta deriva de las células germinales. La mayoría de estos tumores son teratomas, que se clasifican en maduros quísticos, monodérmicos, inmaduros o teratomas malignos.
Los teratomas maduros quísticos representan el 55-70% de las neoplasias ováricas, y en un 10% de los casos pueden ser bilaterales. Su presentación clínica puede variar, desde asintomáticos, a dolor abdominal de inicio agudo y en algunos casos con torsión del anexo.9
Dentro de los tumores malignos, los derivados de las células germinales son los más prevalentes. El disgerminoma es el más frecuente.10
De los tumores malignos derivados de las células germinales, los teratomas inmaduros que representan <1% pueden contener tejido del saco vitelino. Su presentación clínica es similar a la de los teratomas, con dolor abdominal o masa anexial/pélvica palpable, y ocurre más frecuentemente en la segunda y tercera década de vida.11 Estos tumores, se consideran una variedad maligna dentro de los tumores germinales, y su clasificación depende de la cantidad de tejido inmaduro neuroepitelial que presente.12 El tratamiento siempre es quirúrgico, y la sobrevida es alta en estadios iniciales y de bajo grado.
Caso Clínico
Se presenta una adolescente de 10 años y 3 meses de edad que fue derivada al consultorio de ginecología infanto juvenil por presentar un blastoma anexial. Al momento de la consulta se encontraba asintomática y dicha ecografía fue solicitada por su pediatra de cabecera en el contexto de un episodio de molestias abdominales inespecíficas. En esta ecografía presentó un blastoma anexial. La adolescente no tenía antecedentes relevantes de enfermedad, ni cirugías previas, no había presentado aún su menarca. Al examen físico se constató un crecimiento y desarrollo acordes a su edad, con un Tanner mamario III, Tanner pubiano II, peso 39,5 Kilogramos, talla de 1,49 metros e IMC: 17,79. El abdomen se presentaba blando, depresible e indoloro y no se palpaban masas. Dentro de los estudios complementarios contaba con una primera ecografía ginecológica pelviana con un útero de aspecto infantil, y el ovario izquierdo desplazado por una imagen quística simple de 38 x 15 x 20 mm sin flujo al examen Doppler. (Figura 1). Adjuntaba un laboratorio con marcadores tumorales CA-125: 16,40 CA 19-9: 19,70, ambos dentro de valores normales.
Dado el cuadro asintomático de la paciente y la baja sospecha de malignidad de la imagen ovárica, se decidió en forma conjunta con sus padres la conducta expectante con pautas de alarma de torsión anexial, el seguimiento de la paciente y la imagen anexial, citando a control estricto a los 3 meses con una nueva ecografía.
En la consulta de seguimiento a los tres meses, en la nueva ecografía se observó que la imagen había aumentado de tamaño, presentando el ovario izquierdo con imagen unilocular de 54 x 48 x 55 mm, ovalada, anecoica de paredes finas, sin flujo al examen Doppler. (Figura 2). Dado el aumento de tamaño en el tiempo transcurrido se decidió en conjunto con el equipo de cirugía pediátrica su tratamiento quirúrgico laparoscópico. En la cirugía se evidenció el ovario izquierdo aumentado de tamaño, a expensas de una formación de paredes lisas (Figura 3). El ovario contralateral era de características normales, al igual que el resto de la pelvis. No se observó líquido libre. Se realizó la quistectomía. Se aspiró contenido intraquístico seroso/citrino. Se extrajo el quiste mediante técnica con bolsa. Se envió el material a anatomía patológica. El ovario remanente presentó características macroscópicas normales, se logró conservar gran parte del ovario. La paciente cursó su post operatorio sin intercurrencias, con el alta hospitalaria a las 24 horas.
La anatomía patológica informó un diagnóstico de teratoma inmaduro G1. (Figura 4.)
Dado el hallazgo histológico, se decidió realizar ateneo conjunto interdisciplinario con la participación de los servicios de Oncología pediátrica, Diagnóstico por Imágenes, Anatomía Patológica, Cirugía Pediátrica, Pediatría y Ginecología Infanto Juvenil, para así establecer la mejor terapéutica y seguimiento del caso.
Dado que por ecografía, laparoscopia y marcadores tumorales no se evidenció ni se sospechó extensión de la enfermedad, se decidió en ateneo conjunto realizar seguimiento mediante imágenes con ecografía y marcadores tumorales a los 3 meses.
En el primer control ecográfico postquirúrgico se evidenciaron ambos ovarios de forma, tamaño y ecoestructura conservada. El ovario derecho de 26 x 18 x 18mm con un volumen de 4.7 cc. y un ovario Izquierdo de 41 x 15 x 15mm con un volumen de 5.1 cc. El útero 44 x 11 x 23 mm. Relación Cuerpo - Cuello: 2/1. No mostró líquido libre abdominal. Marcadores tumorales negativos.
La paciente continuó con controles semestrales con ecografía y marcadores tumorales. Durante el transcurso de 18 meses todos los controles fueron negativos, la adolescente continuó su crecimiento y desarrollo con normalidad, presentando su menarca a los 11 años y 9 meses.
Actualmente han pasado aproximadamente 24 meses posteriores a la cirugía, sin evidenciarse sospecha de recurrencia. Continúa con controles estrictos.
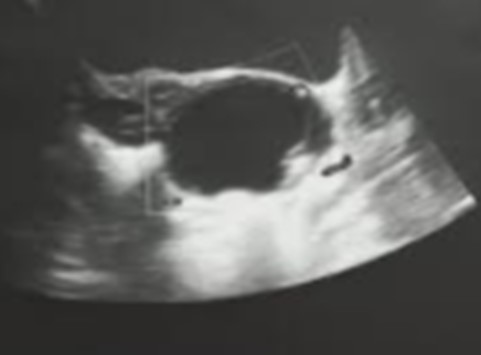
Figura 1. Fotografía de primer ecografía ginecológica.
Fotografía de ecografía ginecológica. Útero de aspecto infantil. Ovario izquierdo desplazado por imagen quística simple 38 x 15 x 20 mm. Doppler negativa.
Figura 2. Fotografía de segunda ecografía ginecológica.
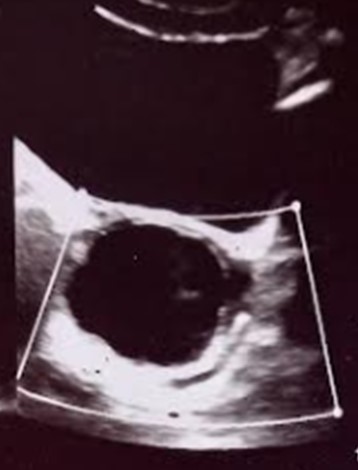
Fotografía de ecografía ginecológica: Útero 49 x 12 x 24mm desplazado a la derecha por imagen ovárica izquierda. Ovario izquierdo aumentado de tamaño, mide 74 x 48 x 55mm ocupado por imagen de 54 x 45 x 13mm unilocular, ovalada, anecoica de paredes finas, Doppler negativa.
Figura 3. Imágenes correspondientes a la cirugía.
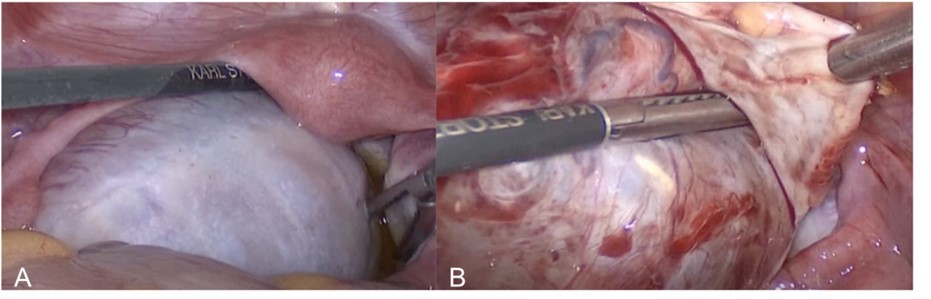
- Ovario izquierdo macroscópicamente aumentado de tamaño, de paredes lisas. Útero infantil.
- Superficie del ovario y del quiste. Quistectomía.
Figura 4. Microscopía de ovario izquierdo.
A y B
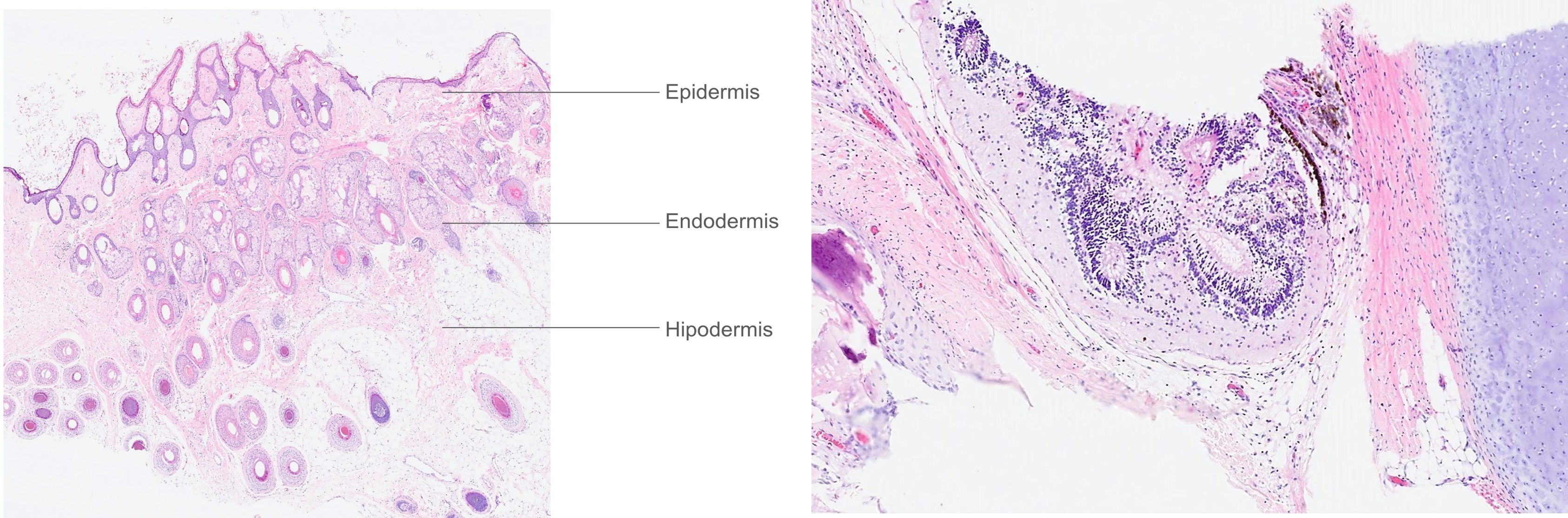
- Microscopia: Formación quística constituida por elementos derivados de meso, ecto y endodermo, con epidermis con anexos cutáneos, numerosas glándulas y estroma adiposo y muscular. Presencia de tejido glial maduro y dos focos aislados con rosetas neuroepiteliales. Tejido dermoide: Ectodermis- Endodermis – Mesodermis.
B: Roseolas. Dentro de estas roseolas que contienen atipia en el componente inmaduro neuroepitelial.
Discusión
Las masas anexiales en la población pediátrica son una entidad poco frecuente. Cuando se presentan, la mayoría de las veces debutan con dolor abdominal, distensión abdominal, masa palpable. En algunas ocasiones, puede dar un cuadro de abdomen agudo quirúrgico, con torsión anexial y compromiso del anexo o hemorragia.13 Algunos quistes funcionales del ovario, o neoplasias pueden producir hormonas, y en algunos casos desencadenar pubertad precoz en pacientes premenárquicas.14
Se realizó una búsqueda bibliográfica en PubMed incluyendo la terminología “teratoma inmaduro de ovario en población pediátrica y adolescente”. Tabla 1.
El abordaje inicial de un blastoma anexial debe incluir ecografía pelviana ginecológica y en algunas ocasiones dosaje de marcadores tumorales, cuando se sospecha mayor patología.15,16
La sospecha de malignidad en este rango etario suele ser raíz de síntomas inespecíficos. Se ha encontrado alguna asociación para sospechar malignidad cuando presentan dolor abdominal, distensión, masa palpable o pubertad precoz.8
El dosaje de marcadores debe incluir Gonadotrofina coriónica humana fracción ß (ßHCG), Alfafetoproteina (AFP), Lactodohidrogensa (LDH), CEA, F5 Embrioglucano y CA-125 entre otros.8
Autores como Saba consideran que es dificultoso el diagnóstico diferencial por imágenes de un teratoma maduro con uno inmaduro. Sin embargo, los teratomas inmaduros pueden presentar más elementos sólidos visibles por Tomografía axial computada o Resonancia Magnética. La presencia de componentes sólidos con un pequeño componente graso y calificaciones pueden ayudar al diagnóstico pre operatorio.17
La cirugía debe ser conservadora y con criterio de preservación de la fertilidad, en la medida de lo posible. Cuando se sospecha malignidad, la ooforectomía, lavados peritoneales, biopsias peritoneales, omentectomía y linfadenectomía debe ser la conducta a realizar en la mayoría de los casos. La biopsia del ovario contralateral no está indicada. (7,18)
Es importante que el cirujano, tenga experiencia en el manejo de esta patología, y evitar la ruptura del quiste, o derramar contenido a la cavidad, ya que esto cambia el estadio de la enfermedad, y en su defecto el tratamiento y sobrevida.15
En el 60-70% de los casos, se presentan en Estadios iniciales (Estadio I), dado su rápida aparición, crecimiento y sintomatología.19,20
El tratamiento y seguimiento posterior a la cirugía, depende fuertemente de la histología del tumor y de su estadio.18, 21
En estadios I A G1 (Tabla 2)22 de los teratomas inmaduros no está indicado tratamiento posterior, solo seguimiento, que según las guías del National Comprehensive Cancer Network (NCCN) debe ser cada dos meses con examen físico y marcadores tumorales, e imágenes (Radiografía de tórax o tomografía de abdomen y pelvis) cada 3 a 4 meses.22,23
En el seguimiento, para detectar la recurrencia de los tumores malignos de ovario, se ha visto un trabajo realizado en el 2020, pacientes con una edad media de 11 años al momento de la cirugía operadas mediante cirugía abierta con ooforectomía total en el primer acto quirúrgico y diagnóstico de teratoma inmaduro. Cuando se evaluó la recurrencia, en 6 casos se diagnosticó un tumor metacrónico es decir, un segundo tumor maligno entre 6 meses y 10 años luego del diagnóstico del primer cáncer. La detección del tumor metacrónico se realizó durante el seguimiento, dentro de los 12 a 32 meses posteriores, y la mayoría de las pacientes se encontraban asintomáticas al momento del diagnóstico. Las recurrencias fueron detectadas mediante los estudios de control por ecografía. Una sola paciente se presentó a la guardia por sintomatología de dolor abdominal.25
En lo que respecta a la preservación de la fertilidad, si bien no existe evidencia suficiente aun que respalde cual es la mejor estrategia de preservación de fertilidad en adolescentes que tienen antecedentes de cáncer de ovario, si hay consenso de que se debe dar importancia a la preservación de fertilidad en conjunto con el diagnóstico y tratamiento.29 En las pacientes premenárquicas, la única estrategia posible es la preservación de tejido ovárico. Actualmente, se están desarrollando técnicas de maduración de ovocitos en tejido ovárico, que podrían ser un futuro prometedor para estas pacientes, dado que implantar tejido ovárico en pacientes con antecedentes de patología tumoral ovárica, no garantiza seguridad de recurrencia.
Conclusiones
Los blastomas anexiales en las pacientes premenárquicas son poco frecuentes. A pesar de su baja prevalencia, es importante tener presente la posibilidad de presentación de un tumor maligno. Existen múltiples estudios que orientan y ayudan a categorizar el grado de sospecha. Sin embargo, a pesar de tener marcadores tumorales negativos, siempre hay que intentar realizar una cirugía con criterio oncológico, y en la medida de lo posible conservadora del anexo.
Los teratomas inmaduros por su estirpe histológica pueden no elevar marcadores tumorales. Por lo que, aunque exista baja sospecha, es de vital relevancia que en caso de que se pueda realizar la quistectomía, evitar que el quiste se rompa y se derrame contenido a la cavidad peritoneal, por el riesgo mínimo de que exista mayor patología en diferido.
Está descripto que puede existir recurrencia de la enfermedad, por lo que el seguimiento clínico, y el desarrollo puberal adecuado forman parte de un estándar de cuidado y tratamiento en estos casos.
Tabla 1. Revisión de artículos de Teratoma Inmaduro en población pediátrica y adolescente.
|
Autor |
N° Casos |
Edad de presentación |
Presentación clínica |
Localización |
Hallazgos en imágenes |
M. T. |
Cirugía realizada |
|
Shinkai T, Masumoto K (26) |
7 |
9 (7–13) |
Dolor abdominal, masa palpable, náuseas. |
Ovario derecho |
Imagen quística con componente sólido y focos de calcificación y grasa. |
AFP |
Abierta: 2 pacientes quistectomía, 5 pacientes salpingooforectomía |
|
6 |
(4.7-11) |
dolor abdominal, masa palpable |
|
|
|
2 Salpingooforectomia, 2 salpingooforectomía + estadificación 1 ooforectomía |
|
|
Brown M F, Hebra A (7) |
4 |
11.8 |
dolor, náuseas y vómitos |
|
masa sólida
|
AFP HCG |
SalpingooforectomíaOoforectomía. |
|
Einarsson J.I., Edwards C.L. (11) |
1 |
13 |
dolor abdominal - masa palpable |
ovario derecho |
imagen quística de 18 cm del anexo derecho |
AFP, β-hCG CA-125 CEA |
Salpingooforectomía Laparotómica, linfadenectomía y biopsias peritoneales, de diafragma y Fondo de Saco de Douglas. Apendicectomía |
|
Cushing B, Giller R (28) |
31 |
10 (1.5-15) |
|
17 casos Ovario izquierdo 1 ambos ovarios y útero 13 casos ovario derecho
|
|
AFP(Elevada en 10 casos) |
salpingooforectomía abierta 1 salpingooforectomía bilateral + histerectomía |
Tabla 2. Estadificación quirúrgica FIGO de cáncer de ovario, trompa uterina y peritoneo 2021. Adaptado de Staging established by the International Federation of Gynecology and Obstetrics (FIGO): Berek JS, Renz M, Kehoe S, et al: Cancer of the ovary, fallopian tube, and peritoneum: 2021 (22)
Estadio 1. Tumor limitado a los ovarios o las trompas de Falopio.
1A: Tumor limitado a un ovario/ trompa, con cápsula intacta, sin tumor en la superficie ovárica o tubaria; líquido ascítico o lavados negativo.
1B: ambos ovarios o trompas, con cápsula intacta. Sin tumor en la superficie del ovario o la trompa; líquido ascítico o lavados negativo.
C: Tumor limitado a uno o ambos ovarios o trompas uterinas, más:
1C1: Derrame quirúrgico
1C2: cápsula rota antes de la cirugía o tumor en la superficie del ovario o la trompa uterina
1C3: Lavados peritoneales o líquido ascítico positivo para células neoplásicas.
Estadio 2. Tumor en uno o ambos ovarios o trompas con extensión pelviana o cáncer peritoneal
2A: Extensión y/o implantes en el útero, las trompas uterinas y/o los ovarios.
2B: Extensión y/o implantes en otros tejidos pelvianos intraperitoneales
Estadio 3: Tumor en uno o ambos ovarios o trompas uterinas o cáncer peritoneal con metástasis peritoneales confirmadas en la microscopia fuera de la pelvis y/o metástasis a los ganglios linfáticos retroperitoneales.
3A1: ganglios linfáticos retroperitoneales positivos (confirmados mediante histología) 3A1i: metástasis <10mm, 3A1ii: > 10mm.
3A2: Compromiso peritoneal microscópico extrapélvico, con o sin ganglios linfáticos retroperitoneales positivos.
3B: Metástasis peritoneales macroscópicas que se extienden más allá de la pelvis y que tienen ≤ 2 cm de dimensión mayor y ganglios linfáticos retroperitoneales positivos o negativos.
3C: Metástasis peritoneales macroscópicas más allá de la pelvis, > 2 cm, con o sin metástasis a los ganglios linfáticos retroperitoneales. Incluye la extensión del tumor a la cápsula del hígado y el bazo sin compromiso parenquimatoso.
Estadio 4: Metástasis a distancia, excluidas las metástasis peritoneales
4A: Derrame pleural con citología positiva.
4B: Metástasis en parénquima y/o metástasis a órganos extra-abdominales (incluidos los ganglios linfáticos inguinales y los que están fuera de la cavidad abdominal)
Bibliografía
- Kirkham YA, Lacy JA, Kives S, et al: “Characteristics and management of adnexal masses in a Canadian pediatric and adolescent population”. J Obstet Gynaecol Can 2011; 33:935 DOI: 10.1016/s1701-2163(16)35019-8
- Hermans AJ, Kluivers KB, Wijnen MH, et al: “Diagnosis and treatment of adnexal masses in children and adolescents”. Obstet Gynecol 2015; 125:61.PMID: 25730223 DOI: 10.1097/AOG.0000000000000665
- Spinelli C, Buti I, Pucci V, et al: “Adnexal torsion in children and adolescents: new trends to conservative surgical approach – our experience and review of literature”. Gynecol Endocrinol 2013; 29:54 ) DOI: 10.3109/09513590.2012.705377
- Eskander RN, Bristow RE, Saenz NC, et al. “A retrospective review of the effect of surgeon specialty on the management of 190 benign and malignant pediatric and adolescent adnexal masses”. J Pediatr Adolesc Gynecol 2011;24:282–5.DOI: 10.1016/j.jpag.2011.03.012
- Bristow R, Nugent A, Zahurak M, et al. “Impact of surgeon specialty on ovarian- conserving surgery in young females with an adnexal mass”. J Adolesc Health 2006;39:411–6. DOI: 10.1016/j.jadohealth.2005.12.022
- Hazard FK, Longacre TA. “Ovarian surface epithelial neoplasms in the pediatric population: incidence, histologic subtype, and natural history”. Am J Surg Pathol 2013;37: 548–53. DOI: 10.1097/PAS.0b013e318273a9ff
- Brown MF, HA, McGeehin K, et al. “Ovarian masses in children: a review of 91 cases of malignant and benign masses”. J Pediatr Surg 1993;28:930–2. DOI: 10.1016/0022-3468(93)90700-u https://www.jpedsurg.org/article/0022-3468(93)90700-U/pdf
- E J. Renaud, S Sømme,S Islam, et al. “Ovarian masses in the child and adolescent: An American Pediatric Surgical Association Outcomes and Evidence-Based Practice Committee systematic review”. Journal of Pediatric Surgery. (2018), DOI: 10.1016/j.jpedsurg.2018.08.058
- Choudhary S, Fasih N, Mc Iness M, et al. “Imaging of ovarian teratomas: appearances and complications”. J Med Imaging Radiat Oncol. 2009; 53:480-488. DOI: 10.1111/j.1754-9485.2009.02085.x
- Oberaigner W, Minicozzi P, Bielska-Lasota M, et al. “Survival for ovarian cancer in Europe: The across-country variation did not shrink in the past decade.”Eurocare Working Group. Acta Oncol 2012;51:441–53. DOI: 10.3109/0284186X.2011.653437
- Einarsson JL , Edwards CL, Zurawin RK. “Immature ovarian teratoma in an adolescent: a case report and review of literature”. J Pediatric adolescent Gynecology. 2004; 17:187-189.) DOI: 10.1016/j.jpag.2004.03.039
- WHO.IARC. Pathology and Genetics Tumors of the Breast and Female Genital Organs. 2003: 3rd Edition, Volume 4 (163-175)
- Deligeoroglou E, Eleftheriades M, Shiadoes V, et al. “Ovarian masses during adolescence: clinical, ultrasonographic and pathologic findings, serum tumor markers and endocrinological profile”. Gynecol Endocrinol. 2004; 19:1–8. DOI: 10.1080/09513590410001712895
- Kanizsai B, Orley J, Szigetvari I, et al. “Ovarian cysts in children and adolescents: their occurrence, behavior, and management”. J Pediatr Adolesc Gynecol. 1998;11:85–88. DOI: 10.1016/S1083-3188(98)70117-2
- Royal College of Obstetricians and Gynaecologists. “Management of suspected ovarian masses in premenopausal women”. Green-top Guideline No. 62. London: RCOG; 2011. https://www.rcog.org.uk/media/0mebp0mv/gtg_62.pdf
16. Royal College of Obstetricians and Gynaecologists. “Management of Female Malignant Ovarian Germ Cell Tumours”. Guideline No. 52. November 2016 https://www.rcog.org.uk/media/spph3igq/sip_52.pdf - Saba L, Guerriero S, Sulcis R, et al. “Mature and immature ovarian teratomas: CT, US and MR imaging characteristics”. Eur J Radiol 2009;72:454–63. DOI: 10.1016/j.ejrad.2008.07.044
- M.A. Álvarez-Avitia, J. Bañuelos-Flores: “Tumores germinales de ovario”.
Instituto Nacional de Cancerología, SS; 2 Unidad Médica de Alta Especialidad, Gaceta Mexicana de Oncología. 2018;Supl 2 https://biblat.unam.mx/hevila/Gacetamexicanadeoncologia/2018/vol17/supl2/9.pdf - Smith HO, Berwick M, Verschraegen CF, et al. “Incidence and survival rates for female malignant germ cell tumors”. Obstet Gynecol 2006;107: 1075–85. DOI: 10.1097/01.AOG.0000216004.22588.ce
- Solheim O, Kærn J, Tropé CG, et al. “Malignant ovarian germ cell tumors: presentation, survival and second cancer in a population based Norwegian cohort” (1953–2009). Gynecol Oncol 2013;131:330–5. DOI: 10.1016/j.ygyno.2013.08.028
- Berek JS, Renz M, Kehoe S,et al: Cancer of the ovary, fallopian tube, and peritoneum: 2021 update. International Federation of Gynecology and Obstetrics (FIGO): Int J Gynaecol Obstet 155 Suppl 1:61–85, 2021. doi: 10.1002/ijgo.13878. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9298325/pdf/IJGO-155-61.pdf
- Berek JS, Renz M, Kehoe S,et al: Cancer of the ovary, fallopian tube, and peritoneum: 2021 update. Staging established by the International Federation of Gynecology and Obstetrics (FIGO):. Int J Gynaecol Obstet 155 Suppl 1:61–85, 2021. doi: 10.1002/ijgo.13878
- NCCN. Ovarian Cancer Including Fallopian Tube Cancer and Primary Peritoneal Cancer Version 3.2021 — September 9, 2021.www.nccn.org/patients
- S. Emans, M. Laufer, Goldstein. Masas anexiales. Ginecología en la infancia y adolescencia. Cap 21. 381-404. Edición 6ta. Año 2012
- S Braungart, RJ Craigie, P Farrelly. “Ovarian tumors in children: how common are lesion recurrence and metachronous disease? A UK CCLG Surgeons Cancer Group nationwide study”. Journal of Pediatric Surgery 55 (2020) 2026–2029 DOI: 10.1016/j.jpedsurg.2019.10.059
- T. Shinkai, K. Masumoto, F. Chiba. “Pediatric ovarian immature teratoma: histological grading and clinical characteristics”. Journal of Pediatric Surgery 55 (2020) 707–710. DOI: 10.1016/j.jpedsurg.2019.04.037
- 27. J I Einarsson 1, C L Edwards, R K Zurawin “Immature ovarian teratoma in an adolescent: a case report and review of the literature”. J Pediatr Adolesc Gynecol. 2004 Jun;17(3):187-9. DOI: 1016/j.jpag.2004.03.039
- Cushing B, Giller R, Albin A, “Surgical resection alone is effective treatment for ovarian immature teratoma in children and adolescents: A report of the Pediatric Oncology Group and the Children’s Cancer Group”. Am J Obstet Gynecol. August 1999: 355-350. DOI: 10.1016/s0002-9378(99)70561-2
- Guzy L, Deemestere I. “Assessment of ovarian reserve and fertility preservation strategies in children treated for cancer” Minerva Ginecologica 2017 February;69(1):57-67 DOI: 10.23736/S0026-4784.16.03992-7
- Médica Tocoginecóloga, Hospital Británico de Buenos Aires.
- Médica Sección de Cirugía Pediátrica y Urología Pediátrica, Hospital Italiano de Buenos Aires.
- Médica Anatomía Patológica, Hospital Italiano de Buenos Aires.
- Médica Oncóloga Pediatra, Hospital Italiano de Buenos Aires.
- Médica de planta, Sección Infanto Juvenil Hospital Italiano de Buenos Aires.
- Jefa de Sección de Ginecología Infanto Juvenil, Hospital Italiano de Buenos Aires.

